Молекулярность и порядок реакции
Молекулярность реакции определяется числом молекул, участвующих в ее элементарном акте. Реакция может быть мономолекулярной: А®В; бимолекулярной: А+В®С или 2А®В; тримолекулярной: А+2В®С.
Реакции с молекулярностью выше трех встречаются крайне редко, так как вероятность одновременного столкновения четырех и более молекул крайне мала. Реакции, протекающие с участием 4 и более молекул, как правило, включают несколько последовательных стадий.
Порядок реакции определяется суммой показателей степеней, в которых концентрации реагирующих веществ входят в левую часть кинетического уравнения. В большинстве случаев порядок реакции совпадает с молекулярностью. Расхождение возможно в том случае, если одно из реагирующих веществ находится в избытке. В этом случае изменение концентрации одного из реагентов не влияет на скорость реакции, и ее порядок оказывается меньше молекулярности. Как следствие, возможна реакция нулевого порядка.
В живых системах нередко встречается ситуация, когда запасы реагирующего вещества в клетке постоянно пополняются и скорость реакции фактически не зависит от концентрации реагента А. Такая реакция, будучи по сути мономолекулярной, подчиняется закономерности нулевого порядка и не зависит от концентрации:
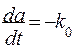
После взятия определенного интеграла в пределах от 0 до t и от ао до а получаем:
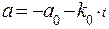
Графически это уравнение прямой линии с тангенсом угла наклона t. Скорость реакции остается постоянной на всем ее протяжении, пока не прекратиться поступление реагирующего вещества в систему.
 2014-02-03
2014-02-03 979
979








