Основной закон химической кинетики.
Элементарной называют реакцию прямого превращения молекул исходных веществ в молекулы продуктов реакции. Элементарная реакция состоит из большого числа однотипных элементарных актов химического превращения.
Число молекул, участвующих в элементарном акте химического превращения, называют молекулярностьюреакции 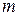 . Если в результате элементарного акта химического превращения изменение претерпевает одна молекула, реакцию называют мономолекулярной (
. Если в результате элементарного акта химического превращения изменение претерпевает одна молекула, реакцию называют мономолекулярной (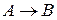 ), 2 – бимолекулярной (
), 2 – бимолекулярной (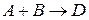 ), 3 – тримолекулярной (
), 3 – тримолекулярной (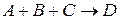 ). Элементарных химических актов с одновременным участием 4 молекул не бывает, так как вероятность одновременного столкновения четырех молекул ничтожно мала.
). Элементарных химических актов с одновременным участием 4 молекул не бывает, так как вероятность одновременного столкновения четырех молекул ничтожно мала.
Молекулярность реакции равна сумме стехиометрических коэффициентов, выражающих число молекул, участвующих в элементарном акте химического превращения. Так для бимолекулярной реакции (210) 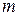 определиться как
определиться как
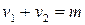 .
.
Таким образом, молекулярность реакции равна: 1, 2 и реже 3.
Экспериментально установлен основной закон химической кинетики или закон действия масс:
скорость элементарной химической реакции прямопропорциональна произведению концентраций молекул реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Если реакция (210) выражает элементарный акт химического взаимодействия, то скорость реакции можно выразить:
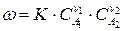 , (211)
, (211)
Большинство химических реакций являются сложными и включают несколько элементарных стадий химического превращения, каждая из которых может быть моно-, би- или реже тримолекулярной. Стадии могут сильно различаться по своим скоростям. Самая медленная стадия химической реакции определяет скорость процесса и называется лимитирующей. Лимитирующая стадия может быть одна, или их может быть несколько, когда две или несколько стадий протекают с близкими скоростями.
Если механизм реакции не изучен и лимитирующая стадия не выявлена, то закон действия масс (211) применяют формально для описания скорости сложных реакции. Если уравнение (210) отражает протекание сложной реакции, то ее скорость можно выразить:
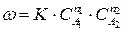 , (212)
, (212)
где 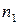 ,
, 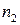 – эмпирические коэффициенты, которые называют частными порядками химической реакции по данному веществу;
– эмпирические коэффициенты, которые называют частными порядками химической реакции по данному веществу;
Сумму частных порядков 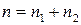 – называют порядком химической реакции. Частные порядки реакции в общем случае не равны стехиометрическим коэффициентам и могут совпадать с ними лишь для элементарных реакций. Частные порядки и общий порядок реакции определяются только экспериментально. Порядок реакции может принимать значения целые, дробные, отрицательные и может быть равен нулю.
– называют порядком химической реакции. Частные порядки реакции в общем случае не равны стехиометрическим коэффициентам и могут совпадать с ними лишь для элементарных реакций. Частные порядки и общий порядок реакции определяются только экспериментально. Порядок реакции может принимать значения целые, дробные, отрицательные и может быть равен нулю.
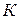 имеет смысл удельной скорости химической реакции, т.е. скорости при концентрациях реагирующих веществ, равных 1. Константа скорости химической реакции не зависит от времени протекания реакции и концентрации реагирующих веществ, а определяется только природой этих веществ, характером химического превращения (присутствием катализатора) и температурой процесса. Константа скорости химической реакции величина постоянная при постоянной температуре.
имеет смысл удельной скорости химической реакции, т.е. скорости при концентрациях реагирующих веществ, равных 1. Константа скорости химической реакции не зависит от времени протекания реакции и концентрации реагирующих веществ, а определяется только природой этих веществ, характером химического превращения (присутствием катализатора) и температурой процесса. Константа скорости химической реакции величина постоянная при постоянной температуре.
Размерность константы скорости включает время протекания процесса и меняется в зависимости от порядка реакции:
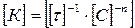 . (213)
. (213)
 2014-02-12
2014-02-12 15758
15758
