Пример 5.3.3
Разобрать работу гальванического элемента
Cd | Cd2 + (a =0.125) || Zn2 + (a =0.001) | Zn:
вычислить э.д.с.;
написать уравнения электродных процессов;
определить направление тока во внешней цепи;
вычислить DG.
Решение.
В таблице приложения находим значения стандартных электродных потенциалов
j0298 Zn|Zn2+ = - 0.76 B, j0298 Cd|Cd2+ = - 0.40 B
Электроны во внешней цепи перемещаются от цинкового электрода к кадмиевому, поэтому цинковый электрод в данной цепи будет заряжен отрицательно, а кадмиевый положительно.
На цинковом электроде идет реакция окисления
Zn0 - 2e = Zn2 +
На кадмиевом - восстановления ионов Cd2 + раствора
Cd2 + + 2e = Cd0
Суммарная реакция, за счет которой работает гальванический элемент:
Zn0 + Cd2 + = Cd0 + Zn2 +
Э.д.с., Е, вычисляется по уравнению (5.9).
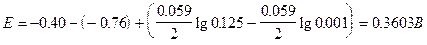
Изменение свободной энергии DG рассчитываем по уравнению:
DG = - n*F*E = -2*96500*0.3603 = - 69.54 кДж/моль.
После изучения темы «Электрохимические процессы» студент должен
знать:
* механизм возникновения электродного потенциала, уравнение Нернста;
* классификацию электродов;
* химические и концентрационные гальванические элементы;
* термодинамику гальванических элементов.
уметь:
* рассмотреть работу гальванического элемента;
* определить анод и катод;
* написать уравнения реакций, происходящих на электродах;
* рассчитать э.д.с. и термодинамические характеристики электрохимической
цепи.
Контрольные задания 61 -70.
Составьте электрохимическую цепь из предложенных электродов и рассмотрите ее работу при Т = 298 К:
· укажите анод, катод и определите знаки электродов;
· напишите уравнения электродных процессов;
· определите направление движения электронов во внешней цепи;
· рассчитайте э.д.с. элементов;
· рассчитайте изменение свободной энергии реакции, протекающей в гальваническом элементе;
· укажите тип гальванической цепи.
| Вариант | Электроды |
| 61. | Zn2+ (a=0.01)½Zn; Cl2½2Cl- (a=0.10) |
| 62. | Ag + ½Ag (a=0.05); S½S2- (a=1.00) |
| 63. | Pb2+(a=0.50) ½Pb; Cd½Cd2+ (a=0.10) |
| 64. | Mg2+(a=0.01)½Mg; Cu½Cu2+ (a=0.10) |
| 65. | Zn2+(a=0.10) ½Zn; Zn2+ ½Zn (a=0.0001) |
| 66. | Fe2+ (a=0.20)½Fe; Mn2+ ½ Mn (a=1.00) |
| 67. | Fe3+(а=1.00)½Fe2+ (a=0.05); Pt; H2½2H + (a=0.10) |
| 68. | Ag +(a=1.00) ½Ag; Ag + (a=0.001)½Ag |
| 69. | Sn4+ (a=2.00)½Sn2+ (a=0.01); Pt; S/S2- (a=0.10) |
| 70. | Ni2+ (a=0.01) ½Ni; Cu2+ (a=0.10) ½Cu |
 2022-01-07
2022-01-07 217
217








