5.3. Термодинамика гальванических элементов
Если гальванический элемент работает термодинамически обратимо, то при этом совершается максимальная полезная работа, равная:
Amax = - DG = n FE (5.14)
где Е - электродвижущая сила цепи.
Изменение энтропии реакции, происходящей в гальваническом элементе, можно рассчитать, пользуясь соотношениями:

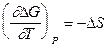 тогда
тогда 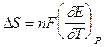 (5.15)
(5.15)
где - 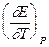 температурный коэффициент гальванического элемента, который показывает на сколько вольт изменяется электродвижущая сила цепи при изменении температуры на 1 градус.
температурный коэффициент гальванического элемента, который показывает на сколько вольт изменяется электродвижущая сила цепи при изменении температуры на 1 градус.
Величину энтальпии реакции получаем, применив уравнение Гиббса - Гельмгольца:
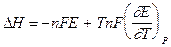 (5.16)
(5.16)
Пример 5.3.1.
Э.д.с. элемента Cu | Cu2 + (a = x) || Cu2 + (a = 1) | Cu равна 0.0885 В при 250С. Определить x.
Решение.
Представленный элемент относится к концентрационным цепям, поэтому расчет производится по уравнению
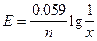 ;
; 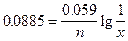 .
.
Отсюда х = 0.001. Активность ионов меди в анодном пространстве равна 0.001 моль/л.
Пример 5.3.2.
Определить константу равновесия реакции, протекающей в элементе:
Zn | Zn2 + (a =1) || Cu2 + (a =1) | Cu.
Решение.
Константа равновесия может быть вычислена из уравнения:
DG = - RT ln K (5.17)
Изменение свободной энергии связано с э.д.с. элемента уравнением (5.14), откуда находим
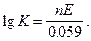
Находим э.д.с. Е = 0.34 - (- 0.76) = 1.10 В, следовательно
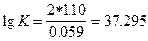 , К = 1.972*1037.
, К = 1.972*1037.
 2022-01-07
2022-01-07 81
81








