Понятие числа степеней свободы
ТЕРМОДИНАМИКА
Лекция 4
Основная
СПИСОК ЛИТЕРАТУРЫ
1. Грабовский, Р.И. Курс физики. / Р.И. Грабовский. – 6-е изд – СПБ.: Издательство «Лань», 2002.- 608 с
2. Пронин, В.П. Краткий курс физики / В.П. Пронин. – Саратов. ФГОУ ВПО «Саратовский ГАУ», 2007 г. – 200 с
3.
Дополнительная
1. Основы физики и биофизики / А.И. Журавлев [и др.] – М.: Мир. 2005. – 384 с.
2. Пронин, В.П. Практикум по физике: уч. пособия / В.П. Пронин.- 2-е изд.– краткий курс физики. – Саратов. СГАУ. 2007 г., 200с.
3. Телесин, Р.В. Молекулярная физика: Учебное пособие 3-е издание / Р.В. Телесин. –С.-Петербург: Издательство «Лань», 2009г.- 368с. 1000 экз.
Понятие числа степеней свободы. Числом степеней свободы называется число независимых координат, определяющих положение молекулы или тела в пространстве. Молекулы в газах движутся беспорядочно, при этом они совершают поступательный и вращательный вид движения.
Максимальное число степеней свободы молекул = 6 (3 поступательных и 3 вращательных степеней свободы).
Одноатомная молекула имеет три поступательных степени свободы. При вращении одноатомной молекулы относительно ее центра, ее положение в пространстве не изменяется, значит, вращательные степени свободы у одноатомных молекул = 0.
Двухатомные молекулы имеют пять степеней свободы: 3 поступательных и 2 вращательных, вращается относительно осей одной линии связи атомов.
Трех и более атомные молекулы имеют все шесть степеней свободы.
Число степеней свободы молекулы – j.
Внутренняя энергия вещества называется суммарная кинетическая энергия всех молекул этого тела.
Внутренняя энергия определяется температурой, а так же от рода вещества.
Внутренняя энергия вещества - 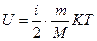 .
.
Внутренняя энергия вещества распределяется по степеням свободы равномерно.
Внутренняя энергия зависит от удельной теплоемкости вещества.
Теплоемкость – это способность вещества накапливать или принимать тепло. Удельная теплоемкость – определяется количеством теплоты, которую нужно сообщить единицы массы, чтобы увеличить его температуру на один Кельвин.
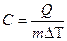
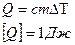
Удельная теплоемкость газов зависит от условий, при которых газ нагревается.
Газ можно нагревать при двух условиях:
1. при постоянном давлении (в этом случае, рассматривается теплоемкость газа при постоянном давлении (Ср.));
2. при постоянном объеме (удельная теплоемкость газа при постоянном объеме (СV)).
Ср больше, чем СV на величину работы, которую совершает газ при нагревании постоянном давлении.
Физический смысл универсальной газовой постоянной. Универсальная газовая постоянная численно равна работе, совершаемой одним молем газа при нагревании его на один Кельвин.
 2014-02-13
2014-02-13 2609
2609








