Гидролизом называется обменная реакция вещества с водой. В результате гидролиза солей сильных кислот и слабых оснований (NH4Cl) или слабых кислот и сильных оснований (СН3СООNa) образуются слабодиссоциированные кислоты или основания, что приводит к нарушению равенства концентраций ионов Н+ и ОН- в растворе и раствор приобретает кислую или щелочную реакцию.
СН3СОО- + Н2О Û СН3СООН + ОН-
Ка = 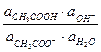
В разбавленных растворах 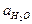 можно считать постоянной:
можно считать постоянной:
Ка × 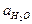 = Кг =
= Кг = 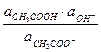
Кг - константа гидролиза.
Константа диссоциации уксусной кислоты:
Кд,к =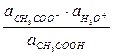 ;
; 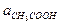 =
= 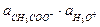 / Кд,к
/ Кд,к
После подстановки (учитывая, что 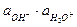 = Кw):
= Кw):
Кг = Кw / Кд,к
Аналогично для соли сильной кислоты и слабого основания (NH4Cl) можно получить:
Кг = Кw / Кд,о
Для соли слабой кислоты и слабого основания:
CH3COO- + NH4+ + H2O Û CH3COOH + NH4OH
Кг =
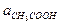 =
= 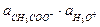 / Кд,к;
/ Кд,к; 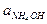 =
= 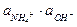 / Кд,о
/ Кд,о
Кг = 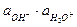 / Кд,к × Кд,о = Кw / Кд,к × Кд,о
/ Кд,к × Кд,о = Кw / Кд,к × Кд,о
Т.о., константы гидролиза солей можно рассчитать, зная константы диссоциации соответствующих слабых кислот и оснований.
Наряду с константой гидролиза реакции гидролиза характеризуются также степенью гидролиза. Степень гидролиза b - доля молекул соли, подвергшихся гидролизу, от общего числа молекул соли.
Для гидролиза CH3COONa:
b = 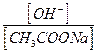
Кг = 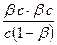 =
= 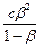
где с - исходная концентрация CH3COONa.
В случае гидролиза соли слабого основания и сильной кислоты связь между Кг и b точно такая же. Зная Кг,можно рассчитать b, решая уравнение:
с b2 + Кг b - Кг = 0
При малых значениях b (b << 1 и 1-b» 1) Кг = с b2 и b = 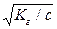 .
.
Если соль образована слабой кислотой и слабым основанием,
Кг = 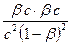 =
= 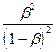
При b<< 1 Кг = b2 и b = 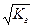 .
.
Анализ уравнений показывает, что степень гидролиза солей слабых кислот и сильных оснований и солей сильных кислот и слабых оснований уменьшается с ростом концентрации соли и увеличивается при разбавлении растворов; степень гидролиза солей слабого основания и слабой кислоты от концентрации раствора практически не зависит.
Зависимость Кг от температуры: Кw возрастает с ростом Т очень значительно, Кд от Т почти не зависит, следовательно, Кг с повышением Т увеличивается, соответственно возрастает и b.
 2014-02-13
2014-02-13 904
904








