Классификация органических реакций.
Кислотно-основные свойства органических соединений
Элетрофильного присоединения и замещения.
Классификация органических реакций. Реакции
План лекции:
1. Понятие субстрата, нуклеофила, электрофила.
2. Классификация органических реакций.
А) обратимые и необратимые
Б) радикальные, электрофильные, нуклеофильные, синхронные.
В) моно- и бимолекулярные
Г) реакции замещения
Д) реакции присоединения
Е) реакции элиминирования
З) кислотно-основные взаимодействия
Реакции региоселективные, хемоселективные, стереоселективные.
3. Реакции электрофильного присоединения. Правило Морковникова, антиморковниковское присоединение.
4. Реакции электрофильного замещения: орентанты 1-го и 2-го рода.
5. Кислотно-основные свойства органических соединений.
А) кислотность и основность по Бренстеду
Б) кислотность и основность по Льюису
6. Теория жестких и мягких кислит и оснований.
Систематизация органических реакций позволяет свести многообразие этих реакций к сравнительно небольшому числу типов. Органические реакции можно классифицировать:
А) по направлению: обратимые и необратимые
Б) по характеру изменения связей в субстрате и реагенте.
Субстрат – молекула, которая поставляет атом углерода для образования новой связи
Реагент - действующее на субстрат вещество.
Реакции по характеру изменения связей в субстрате и реагенте можно разделить на:
А) радикальные R
Б) электрофильные Е
В) нуклеофильные N (Y)
Г) синхронные или согласованные
Е: Ч Е· + Ч· (радикальные) или
гомолитические (газовая фаза, высокая t, облучение)
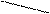 Е: Ч = Е+ (катион) +:Ч¯ (анион)
Е: Ч = Е+ (катион) +:Ч¯ (анион)
Гетеролитические электрофил нуклеофил
Это могут быть ионы Н+ С+Н3 +NО2 – нитрофил или молекулы SО3

 Сб+ Х
Сб+ Х
Нуклеофилы:
А) анионы Н¯, Br¯, ¯OH, [RO¯], HS¯(RS¯)
Б) нейтральные молекулы (основания)
Н2Ö, R – ÖН, R – SН, NН3, R – NН3
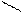
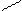
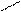
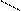 В) С = С
В) С = С
π – связь
 Синхронные
Синхронные

 3 СН = СН для них теряется понятие субстрат и реагент
3 СН = СН для них теряется понятие субстрат и реагент
По числу частиц, принимающих участие в элементарном акте (наиболее медленная стадия)
Мономолекулярная (диссоциативные)
Бимолекулярные (ассоциативные)
Например:

 СН3 СН3
СН3 СН3



 СН3 С – Сl + Н2О СН3 С – ОН + НСl
СН3 С – Сl + Н2О СН3 С – ОН + НСl
СН3 СН3
V = R[(CH3)3 – C – Cl т-к скорость определяется мед. стадией
|
 (CH3)3 – C+ + OH¯ (CH3)3 – C – OH
(CH3)3 – C+ + OH¯ (CH3)3 – C – OH
|
 (CH3)3 – C – Cl (CH3)3 – C+ + Cl¯
(CH3)3 – C – Cl (CH3)3 – C+ + Cl¯  СН3 – СН2 – Cl + -OH
СН3 – СН2 – Cl + -OH
 CH3 – CH2 – Cl + OH¯ CH3 – CH2 – OH + Cl¯
CH3 – CH2 – Cl + OH¯ CH3 – CH2 – OH + Cl¯
V = K [¯OH] [CH3 – CH2Cl]
Соответствие с конечным результатом реакции бывают:
А) реакции замещения
SR SE SN
Б) реакции присоединения
AR AE AN
В) реакции элиминирования
E
 Г) перегруппировки AlCl3 CH3
Г) перегруппировки AlCl3 CH3
 CH3 – CH2 – CH2 – CH2 – CH3 CH3 – CH – CH2 – CH3
CH3 – CH2 – CH2 – CH2 – CH3 CH3 – CH – CH2 – CH3
Пентан Изопентан
Е) кислотно-основные взаимодействия
Реакции также бывают:
Региоселективные – предпочтительно протекающие по одному из нескольких реакционных центров
Хемоселективные – предпочтительное протекание реакции по одной из родственных функциональных групп
Стереоселективные – предпочтительное образование реакции одного из нескольких стереоизомеров.
Основу органических соединений составляют углеводороды. Мы будем рассматривать лишь те реакции, осуществляемых в биологических условиях и соответственно не с самими углеводородами, а с участием углеводородных радикалов.
К ненасыщенным углеводородам мы относим алкены, алкадиены, алкины, циклоалкены и ароматические углеводороды. Объединяющее начало для них π – электронное облако. В динамических условиях также органические соединения склонны подвергаться атаке Е+

 Однако взаимодействие для алкинов и аренов приводит к разным результатам по причине разной природы π – электронного облака: локализованного и делокализиванного. Н2
Однако взаимодействие для алкинов и аренов приводит к разным результатам по причине разной природы π – электронного облака: локализованного и делокализиванного. Н2
 Реакции АЕ С = С + НОН
Реакции АЕ С = С + НОН
Br2
ННаl

 Реакция протекает через образование π и σ – комплекса.
Реакция протекает через образование π и σ – комплекса.




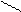



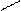 С = С + Е+ С = С медленно Е
С = С + Е+ С = С медленно Е
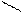
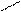 Е+ С – С+
Е+ С – С+
π – комплекс



 НОН
НОН


 СН2 = СН2 + Н+ СН2 = СН2 СН3 – СН2
СН2 = СН2 + Н+ СН2 = СН2 СН3 – СН2
π – комплекс σ – комплекс
 Н
Н

 СН3 = СН2 + +О СН3 – СН2 – ОН
СН3 = СН2 + +О СН3 – СН2 – ОН
Н Н+
Ион этилоксония
 Правило Морковникова – присоединение к непредельным углеводородам несимметричного строения НХ определяется относительной устойчивостью промежуточно образующихся карбокатионов
Правило Морковникова – присоединение к непредельным углеводородам несимметричного строения НХ определяется относительной устойчивостью промежуточно образующихся карбокатионов


 СН3 СН = Сб-Н2 + НСl СН3 – СН = СН2
СН3 СН = Сб-Н2 + НСl СН3 – СН = СН2
НСl

 СН3 - +СН – СН3 + Сl- СН3 – СН – СН3
СН3 - +СН – СН3 + Сl- СН3 – СН – СН3

 O Сl О
O Сl О



 СН2 = СН – С + НСl СН2 = СН = С
СН2 = СН – С + НСl СН2 = СН = С
ОН НСl ОН

 О О
О О





 +СН2 – СН – С + Сl¯ СН2 – СН – С
+СН2 – СН – С + Сl¯ СН2 – СН – С
Н ОН Сl Н ОН
Реакции электрофильного замещения в ароматических системах имеют свои особенности. Первая особенность состоит в том, что для взаимодействия с термодинамически устойчивой ароматической системой требуются сильные электрофилы, которые, как правило, генерируются с помощью катализаторов.

 Е – У поляризация Е б+ - Уб- расщепление Е+ + Ч-
Е – У поляризация Е б+ - Уб- расщепление Е+ + Ч-
Далее идет по знакомому нам механизму
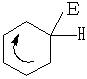


 Е
Е
|



 + Е+
+ Е+
|
π-комплекс
Нарушение ароматичности:


 Е
Е
 ароматичность восстановлена
ароматичность восстановлена
- Н+
 2014-02-13
2014-02-13 2526
2526
