Примером такой молекулы может быть α – аминокислота
 О
О

 R – CH – C кислотный центр
R – CH – C кислотный центр
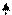 NH2 OH
NH2 OH
основной центр
Это приводит к переносу Н+ с кислотного центра к основному с образованием диполярного иона
 R – CH – COO¯
R – CH – COO¯
+NH3
Общим для всех α – аминокислот является преобладание катионных форм в сильнокислых и анионных в сильнощелочных средах.
Наличие слабых кислотных и основных центров приводит к слабым взаимодействиям – водородным связям. Например: имидазол при небольшой молекулярной массе имеет высокую температуру кипения за счет на личия водородных связей.

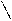
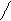 N T кип. = 256оС
N T кип. = 256оС
N
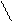
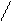
 H ……….. N
H ……….. N
N
H
Как уже говорилось на практических занятиях

 N гистидин -
N гистидин -
 СН2 – СН – СООН участник кислотно-
СН2 – СН – СООН участник кислотно-
 N NН2 основных каталитических
N NН2 основных каталитических
H реакций
Дж. Льюисом предложена более общая теория кислот и оснований, определяющаяся на строении электронных оболочек.
Кислотами по Льюису могут быть атом, молекула или катион, обладающие вакантной орбаталью, способное принимать пару электронов с оборазованием ковалетной связи.
Представителями кислот Льюиса служат галогениды элементов II и III групп периодической системы Д.И. Менделеева (BF3, AlCl3, FeBr3, ZnCl2 и др.), катионы металлов, протоны.
Основания Льюиса (атом, молекула или анион). К основаниям Льюиса относятся амины, спирты, простые эфиры, тиолы, тиоэфиры, содержащие π-связи соединения.
Например, приведенное ниже взаимодействие можно представить взаимодействие кислот и оснований Льюиса
Br- + AlBr3 AlBr4-
основание Льюиса кислота Льюиса
 Важным следствие теории Льюиса является то, что любое органическое вещество можно представить как кислотно-основной комплекс.
Важным следствие теории Льюиса является то, что любое органическое вещество можно представить как кислотно-основной комплекс.
В соответствии с принципом жестких и мягких кислот и оснований (ЖМКО) Пирсона кислоты Льюиса делятся на жесткие и мягкие. Внутримолекулярные связи возникают значительно реже, чем межмолекулярные, но также имеют место в биоорганических соединениях.



 СН3 – С = СН – С – СН3 СН3 – С – СН2 – С – СН3
СН3 – С = СН – С – СН3 СН3 – С – СН2 – С – СН3
ОН …….. О О О
Ацетилацетон енольная форма (85%) кетоенольная форма (5%)
Понятие «жесткие» и «мягкие» нетождественные сильным и слабым кислотам и основаниям. Это независимые две характеристики. Суть ЖКМО состоит в том, что жесткие кислоты реагируют с жесткими основаниями и мягкие кислоты реагируют с мягкими основаниями.
| Жесткие основания | Мягкие основания | Жесткие кислоты | Мягкие кислоты |
  Н2О, НО¯ R – OН, RO¯ NH3, NH2¯ ROR RCOO¯ Cl¯, F¯ Н2О, НО¯ R – OН, RO¯ NH3, NH2¯ ROR RCOO¯ Cl¯, F¯ | RSR RSН RS- H¯, J¯ R2C = CR2 | H+, Na+, K+ Mg2+, Ca2+, Mn2+ Al3, AlCl3 RC+ = 0 | Ag+, Cu+Hg2+ J+, Br+ |

 Промежуточные
Промежуточные
 Br-, C6Н5NH2 N Cu2+Fe2+, Zn2+R3C+ C6H5+
Br-, C6Н5NH2 N Cu2+Fe2+, Zn2+R3C+ C6H5+
Принцип ЖМКО может быть продемонстртрован на слудующих примерах:
H
 CH3 – CH – Cβ – H +C2H5ONa CH3 – CH = CH2 + C2H5OH
CH3 – CH – Cβ – H +C2H5ONa CH3 – CH = CH2 + C2H5OH
J H NaJ пропилен
H
 CH3 – CH – C – H +C2H5SNa (CH3)2CH – S - C2H5
CH3 – CH – C – H +C2H5SNa (CH3)2CH – S - C2H5
J H NaJ пропилен
МК М. основание
 2014-02-13
2014-02-13 2933
2933
