Замещение на галоген
Замещение одного или двух атомов водорода
Замещение всех атомов водорода на металл
Присоединяется к кислотам с образованием солей аммония
NH3 + HCl → NH4Cl и в растворе, и в газообразном состоянии
NH3 + H2SO4→ NH4HSO4 гидросульфат аммония
2NH3 + H2SO4→ (NH4)2SO4 сульфат аммония
II. Реакции замещения атома водорода менее характерны, чем кислотно-основные реакции
Al + NH3 t→ AlN + H2 чаще всего нитриды так и получают
Нитриды активных металлов разлагаются водой:
Mg3N2 + H2O → Mg(OH)2 + NH3↑
Нитриды малоактивных металлов устойчивы в воде. Это твердые вещества, устойчивые также к нагреванию.
Na + NH3 t→ NaNH2 + H2 амид натрия (замещен 1 атом водорода)
Амиды активных металлов разлагаются водой:
NaNH2 + H2O → NaOH + NH3↑
Na + NH3 t→ Na2NH + H2 имид натрия (замещено 2 атома водорода)
NH3 + F2 → NH4F + NF3 фторид азота. Весьма устойчив
При действии хлора на раствор хлорида аммония образуется хлорид азота:
NH4Cl + Cl2 → HCl + NCl3
NCl3 – желтая маслянистая жидкость с резким запахом. При ударе или нагревании сильно взрывается:
NCl3 90 °C→ N2 + Cl2
При внесении кристаллов йода в раствор аммиака образуется черный осадок:
J2 + NH3 → NH4J + NH3·NJ3↓ трийодид азота (в виде аддукта с аммиаком)
Трийодид во влажном виде сравнительно устойчив, но после удаления влаги при малейшем прикосновении разлагается со взрывом. Это единственное известное взрывчатое вещество, способное сдетонировать от альфа-излучения.
Аммиак – сильный восстановитель, так как азот находится в низшей степени окисления – 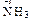
 2014-02-17
2014-02-17 2321
2321








