Распространение в земной коре
История открытия
ПНИКТОГЕНЫ
(гр. "пнигеин" – удушливый. По свойствам азота, который не поддерживает дыхание)
Элементы главной подгруппы V группы – N, P, As, Sb, Bi
Азот (N) – "a zoos – неживой (гр.), nitrogenium – рождающий селитру (лат.)" – 1772 Г. Кавендиш (англ.) открыл азот, но никому не сообщил, кроме своего друга Дж. Пристли (англ.), поэтому первооткрывателем считается Д. Рутерфорд (англ.), который открыл азот независимо от Кавендиша в 1772 г.
Фосфор (P) – "несущий свет (гр.)" – 1669 Х. Бранд (англ.) получил перегонкой смеси мочи и глины.
1680 Р. Бойль получил аналогично. В 1772 году Шееле получил фосфор из костей.
Мышьяк (As) – "arsenik – мужское начало (гр.), мышиный яд (рус.)" – известен с II тыс. лет до н.э. в виде сплавов с медью. Неизвестно, когда получен металлический мышьяк.
Сурьма (Sb) – "stibi – грим, мазь (тюрк.), антимониум – против уединения (лат.)" – известна с III тыс. лет до н.э. В древности ее долгое время принимали за свинец.
Висмут (Bi) – "weisse materia – белая материя (нем.)" – известен с XV в. в Центральной Европе под разными названиями (демогоргон, глаура, нимфа, серое олово и т.д.). До XVIII в. висмут путали со свинцом, оловом и сурьмой. Лишь в XVIII в. Потт и Бергман предложили считать висмут простым веществом.
|
|
|
N – 0,04 %. 9 место по распространенности. В свободном состоянии N2 – в воздухе (78,8 % объемн.) – 4·1015 т в атмосфере. Селитры – KNO3, NaNO3, Ca(NO3)2 – залежи пластами на побережье Тихого и Индийского океанов. Входит в состав белковых молекул – все живые организмы содержат азот.
P – 0,09 %. В свободном состоянии не встречается. В виде минералов – фосфорит Ca3(PO4)2, апатит – 3Ca3(PO4)2·CaX2 (X = F, Cl, OH). В человеческом организме содержится 1 % фосфора – в костях (3Ca3(PO4)2·CaCO3·H2O), нуклеиновых кислотах (в составе АТФ), некоторых белках.
As – 5·10-4 %. В виде минералов – арсенопирит FeAsS, реальгар As4S4, аурипигмент As2S3.
Sb – 5·10-5 %. Немного в свободном состоянии. Sb2S3 – сурьмяный блеск.
Bi – 2·10-5 %. В виде минералов – висмутовый блеск Bi2S3, висмутовая охра Bi2O3.
В ряду N → P → As → Sb → Bi:
·Увеличивается радиус атома (т.к. растет число энергетических уровней), поэтому падают Энергия ионизации и Сродство к электрону (электроны меньше притягиваются к ядру, их проще оторвать);
· Электроотрицательность уменьшается. Азот – третий по электроотрицательности элемент после F и О;
· Металлические свойства возрастают, неметаллические убывают (электроны проще оторвать). N, P – типичные неметаллы, As, Sb – амфотерные элементы, Bi – металл;
· Окислительная способность падает, а восстановительная (у ионов Э3–) – возрастает (т.к. растет радиус атома и падает электроотрицательность, поэтому электроны сложнее принимать и проще отдавать);
|
|
|
· Водородные соединения ЭН3 – устойчивость падает (BiH3 разлагается уже при комнатной температуре), кислотные свойства возрастают (т.к. растет радиус атома, проще оторвать протон Н+);
· Высшие оксиды Э2О5 – устойчивость падает (т.к. радиус растет), кислотность падает (т.к. растут металлические свойства элемента), окислительная способность возрастает (т.к. падает устойчивость).
АЗОТ N2
СТРОЕНИЕ МОЛЕКУЛЫ N2
Структуру молекулы азота можно представить следующим образом: 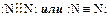
На внешнем уровне атомов азота находится 5 электронов (2s22p3), из которых 3 неспарены. Они образуют тройную связь. Эта связь очень прочная. N2 – единственное газообразное вещество, молекулы которого связаны тройной связью.
Энергия связи 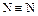 945 кДж/моль (494 для О=О и 242 для Сl–Cl). При 3000 °С распадается лишь 0,1 % молекул N2.
945 кДж/моль (494 для О=О и 242 для Сl–Cl). При 3000 °С распадается лишь 0,1 % молекул N2.
 2014-02-17
2014-02-17 6282
6282







