Частичное окисление
Восстанавливает некоторые металлы из их оксидов
Окисление галогенами
Окисление кислородом
NH3 + O2 → N2 + H2O в недостатке кислорода
NH3 + O2 t,Pt→ NO + H2O в избытке кислорода и в присутствии катализатора
NH3 + Cl2 → NCl3 + NH4Cl
NH3 + Br2 → N2 + HBr бром окисляет менее интенсивно
NH3 + CuO t→ N2 + Cu + H2O эта реакция применяется для удаления пленки оксидов при паянии
NH3 + NaOCl → NaCl + H2O + N2H4 гидразин
Гидразин NH2NH2 – бесцветная жидкость, tпл = 3 °С, tкип = 113 °С. Смешивается с водой в любых соотношениях. ЯДОВИТ. Является восстановителем (т.к. азот в нем находится в степени окисления -2)
N2H4 + O2 → N2 + H2O + Q используется как реактивное топливо
При взаимодействии гидразина с азотистой кислотой образуется азидоводородная кислота:
N2H4 + HNO2 → H2O + HN3
HN3 – бесцветная летучая жидкость с резким запахом. Пары азидоводородной кислоты очень ядовиты, растворы вызывают воспаления при попадании на кожу.
Безводная HN3 взрывается даже при сотрясании сосуда:
HN3 → H2 + N2 + Q
Соли этой кислоты – азиды – по растворимости похожи на галогениды. Азиды щелочных и щелочно-земельных металлов устойчивы к нагреванию. Азиды тяжелых металлов легко взрываются при ударе:
Pb(N3)2 → Pb + N2 азид свинца используется в качестве инициирующего взрывчатого вещества в детонаторах (вещества, взрыв которого вызывает мгновенный взрыв других менее чувствительных взрывчатых веществ).
В промышленности
Непосредственный синтез из элементов – объем производства – 150 млн тонн в год
N2 + H2 →← NH3 t = 450 °C, P= 30 Мпа, Kat = Fe + Al2O3
Процесс циркуляционный – непрореагировавшая смесь азота и водорода после сжижения аммиака снова подается в контактный аппарат
В лаборатории
1) Взаимодействием щелочи или гашеной извести с солью аммония – качественная реакция на катион 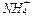
NH4Cl(тв) + Ca(OH)2(тв) → CaCl2 + NH3↑ + H2O
 2014-02-17
2014-02-17 1532
1532







