4. Сместить влево равновесие реакции, термохимическое уравнение которой NH4Cl(тв) ⇄ NH3(г) + HCl(г); 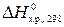 = 177 кДж/моль, можно...
= 177 кДж/моль, можно...
А) Повышением температуры; Б) Отводом HCl; В) Добавлением NH4Cl; Г) Повышением давления;...
Решение.
А) 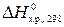 = 177 кДж/моль > 0, значит, согласно табл. 1, повышение температуры смещает равновесие вправо. Это неверный ответ.
= 177 кДж/моль > 0, значит, согласно табл. 1, повышение температуры смещает равновесие вправо. Это неверный ответ.
Б) Отвод HCl, то есть Bj (г), согласно табл. 1, смещает равновесие вправо. Это неверный ответ.
В) Добавление NH4Cl, то есть Ak (тв), согласно табл. 1, не смещает равновесие. Это неверный ответ.
Г) Сумма коэффициентов при формулах газов в левой части уравнения равна нулю, поскольку в левой части уравнения нет формул газов, то есть 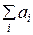 = 0. Сумма коэффициентов при формулах газов в правой части уравнения равна 2 (1 перед NH3(г) + 1 перед HCl(г)), то есть
= 0. Сумма коэффициентов при формулах газов в правой части уравнения равна 2 (1 перед NH3(г) + 1 перед HCl(г)), то есть 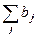 = 2.
= 2. 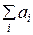 = 0 <
= 0 < 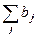 = 2, значит, согласно табл. 1, повышение давления смещает равновесие влево. Это верный ответ.
= 2, значит, согласно табл. 1, повышение давления смещает равновесие влево. Это верный ответ.
5. Уравнение реакции, равновесие которой можно сместить влево/вправо повышением/понижением давления – это...
Решение.
Надо найти суммы коэффициентов, стоящих перед формулами газов в левой и правой частях уравнения реакции, т.е. 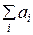 и
и 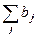 соответственно, а затем сравнить эти суммы между собой и применить табл. 1.
соответственно, а затем сравнить эти суммы между собой и применить табл. 1.
 2014-02-17
2014-02-17 691
691








