РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
1. Формула слабого/сильного электролита – это...
Решение.
Схема 1
| сильные | электролиты | слабые | |||||
| - сильные кислоты: НЭ (Э = Br, Cl, I); HЭO3 (Э = Вг, C1, I, N); НЭО4 (Э = Вг, Cl, I, Mn, Re, Tc); Н2ЭО4 (Э = S, Se); Н2Сг2О7, HNCS; - сильные основания: МОН (M = Cs, Fr, К, Li, Na, Rb, Tl); Μ(ОН)2 (М = Ва, Са, Ra, Sr); - почти все соли. | - слабые кислоты (все, не являющиеся сильными); - слабые основания и амфолиты (все, не являющиеся сильными); - соли Fe(NCS)3, HgCl2, CdI2; - вода Н2O. | ||||||
Примечания.
Общая формула неорганической кислоты – H y An, где An – кислотный остаток (все анионы, формулы которых приведены в табл. 2, кроме OH–, являются анионами кислотных остатков); y – индекс (цифра).
Общая формула оснований и амфолитов – М(ОН) x, где М – металл или NH4 (все катионы, формулы которых приведены в табл. 2, являются катионами металлов); x – индекс (цифра).
Общая формула средней соли – M a An b, где М – металл или NH4; An – кислотный остаток; a, b – индексы (цифры).
1. Формула сильного электролита – это...
А) NH4OH; Б) HF; В) K2SО4;...
Решение.
А) NH4OH – формула основания (М = NH4), которое, согласно схеме 1, является слабым электролитом. Это неверный ответ.
Б) HF – формула кислоты (An = F), которая, согласно схеме 1, является слабым электролитом. Это неверный ответ.
В) K2SО4 – формула соли (М = K, An = SО4), которая, согласно схеме 1, является сильным электролитом. Это верный ответ.
2. Молекулярному уравнению реакции... соответствует краткое ионное уравнение...
Решение.
Для перехода от молекулярного уравнения к краткому ионному надо:
- определить растворимость (Н, М, Р) всех участников реакции с помощью табл. 2;
- определить электролитические свойства (сильный или слабый электролит) всех растворимых участников реакции с помощью схемы 1;
-перенести без изменений в полное ионное уравнение формулы малорастворимых, нерастворимых веществ и слабых электролитов, а также оксидов;
- записать растворимые сильные электролиты в виде формул тех ионов, на которые эти вещества распадаются, учитывая, что сильные кислоты распадаются на H+ и An y –, например, Н2SО4 → 2H+ + SO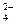 , сильные основания – на M x+ и OH–, например, KOH → K+ + OH–, а средние соли – на M x+ и An y –, например, (NH4)2SО4 → 2NH
, сильные основания – на M x+ и OH–, например, KOH → K+ + OH–, а средние соли – на M x+ и An y –, например, (NH4)2SО4 → 2NH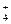 + SO
+ SO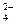 .
.
- вычеркнуть из левой и правой частей полного ионного уравнения одинаковые формулы ионов (вместе с их коэффициентами) и (если надо) сократить оставшиеся коэффициенты.
Таблица 2.
Растворимость электролитов в воде при комнатной температуре (все соединения Cs+, H+, K+, NH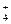 , Na+, Rb+ и нижеприведенных анионов растворимы; все соединения CH3COO
, Na+, Rb+ и нижеприведенных анионов растворимы; все соединения CH3COO , ClO
, ClO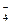 , HCOO
, HCOO , NO
, NO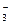 и нижеприведенных катионов растворимы)
и нижеприведенных катионов растворимы)
| катионы | анионы | |||||||||||
| Br– | CO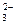 | C2O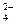 | Cl– | CrO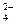 | F– | I– | OH– | РO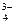 | S2– | SO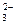 | SO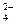 | |
| Ag+ | Н | Н | Н | Н | Н | Р | Н | — | Н | Н | Н | М |
| Al3+ | Р | — | Н | Р | Р | Н | Н | Н | Н | — | — | Р |
| Ba2+ | Р | Н | Н | Р | Н | М | Р | Р | Н | Р | Н | Н |
| Be2+ | Р | [Н] | Н | Р | Р | Р | Р | Н | Н | — | — | Р |
| Ca2+ | Р | Н | Н | Р | Р | Н | Р | М | Н | М | М | М |
| Cd2+ | Р | [Н] | Н | Р | Н | М | Р | Н | Н | Н | М | Р |
| Co2+ | Р | [Н] | Н | Р | Н | Р | Р | Н | Н | Н | Н | Р |
| Cr3+ | Р | — | Н | Р | Н | Н | Р | Н | Н | — | — | Р |
| Cu2+ | Р | [Н] | Н | Р | Н | Р | — | Н | Н | Н | — | Р |
| Fe2+ | Р | [Н] | М | Р | — | Н | Р | Н | Н | Н | Н | Р |
| Fe3+ | Р | — | Н | Р | Р | Н | — | Н | Н | — | — | Р |
| Ga3+ | Р | — | Н | Р | Р | Н | Н | Н | Н | — | — | Р |
| Hg2+ | М | [Н] | Н | Р | Н | М | Н | — | Н | Н | Н | — |
| In3+ | Р | [Н] | Н | Р | — | М | Р | Н | Н | Н | — | Р |
| La3+ | Р | [Н] | Н | Р | Н | Н | Р | Н | Н | — | — | Р |
| Li+ | Р | М | Р | Р | Р | М | Р | Р | Н | Р | Р | Р |
| Mg2+ | Р | М | Н | Р | Р | Н | Р | Н | Н | Н | М | Р |
| Mn2+ | Р | [Н] | Н | Р | Р | Р | Р | Н | Н | Н | — | Р |
| Ni2+ | Р | [Н] | Н | Р | Н | Р | Р | Н | Н | Н | Н | Р |
| Рb2+ | М | [Н] | Н | М | Н | Н | М | Н | Н | Н | Н | Н |
| Sc3+ | Р | [Н] | М | Р | Р | Н | Р | Н | Н | — | Н | Р |
| Sn2+ | Р | — | М | Р | Н | Р | М | Н | Н | Н | — | Р |
| Sr2+ | Р | Н | Н | Р | Н | Н | Р | М | Н | М | Н | Н |
| Tl+ | М | М | М | М | Н | Р | Н | Р | Н | Н | Н | М |
| Y3+ | Р | [Н] | Н | Р | — | Н | Р | Н | Н | — | — | Р |
| Zn2+ | Р | [Н] | М | Р | Н | М | Р | Н | Н | Н | М | Р |
Условные обозначения: Р – растворимое вещество (> 0,1 моль/л); М – малорастворимое (0,001–0,1 моль/л); Н – нерастворимое (< 0,001моль/л); [Н] – из раствора выпадает осадок оснóвной соли и выделяется CO2; — – разлагается водой или не существует.
 2014-02-17
2014-02-17 1986
1986
