Современная теория электролитов была развита в двадцатых годах нашего столетия Дебаем и Гюккелем. В основе этой теории лежит представление о том, что в растворе электролита каждый ион окружен ионной атмосферой, состоящей из противоположно заряженных ионов. Суммарный заряд ионной атмосферы равен по величине, но противоположен по знаку заряду центрального иона.
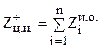 .
.
Плотность заряда по мере удаления от центрального иона понижается. Поскольку между отдельными ионами в данной атмосфере расположены молекулы воды, размер ионной атмосферы зависит от концентрации раствора и очевидно, с уменьшением концентрации – возрастает.
Если принять, что распределение ионов в ионной атмосфере обладает сферической симметрией, ион, окруженный ионной атмосферой, можно сравнить с шаровым конденсатором. Зависимость средней плотности заряда в данной точке такого конденсатора от величины электрического потенциала в этой точке определяется уравнением Пуассона, записанным в сферических координатах при условии сферической симметрии ионной атмосферы:
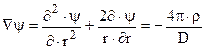 ,
,
где Ñ – оператор Лапласа, r – средняя плотность заряда в точке, для которой потенциал равен y; D – диэлектрическая проницаемость среды, г – координата рассматриваемой точки.
Дебай и Гюккель решили это уравнение, рассматривая процесс образования реального арствора как процесс создания ионной атмосферы вокруг ионов, первоначально находящихся в предельно-разбавленном растворе.
Путем целого ряда преобразований из уравнения Дебая-Гюккеля авторами был выражен коэффициент активности иона в растворе в виде:
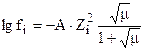 ,
,
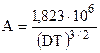 ,
,
где D – диэлектрическая проницаемость среды; Т – температура, оК; Zi – валентность i-го иона (заряд); m - ионная сила раствора.
Средний мольный коэффициент активности электролита в виде:
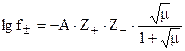
Уравнения а) и б) получили название формулы Дебая-Гюккеля. Т.к. формула выведена без учета химической природы самих ионов, без учета взаимодействия ионов с молекулами воды, а в ходе вывода принимались некоторые допущения, то все это ограничило применение формулы Дебая-Гюккеля областью разбавленных растворов (для растворов с С £ 0,01 моль/л).
При расчете коэффициентов активности ионов в водных разбавленных растворах при комнатной температуре (25оС) формула Дебая-Гюккеля может быть упрощена и приведена к виду:
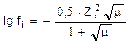
т.к. DH20=81 (при 25оС); Т=298 К, то А=0,5 и

а при определении fi в разбавленных растворах, для которых Öm£0,01, можно пользоваться уравнением

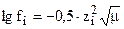
Аналогично для среднего мольного коэффициента активности ионов электролита:
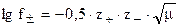
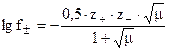
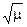 £ 0,01
£ 0,01
Уравнения а) и г), выведенные теоретически, являются ничем иным, как математическим выражением эмпирически открытого правила ионной силы. С их помощью, располагая значением ионной силы раствора, можно рассчитать величину среднего коэффициента активности электролита. При этом совершенно не важно, присутствием каких электролитов обусловлена данная ионная сила раствора.
Покажем таблицей расчетные значения коэффициентов активности ионов при разных значениях ионной силы раствора. При этом, т.к. fi не зависит от природы электролита, а зависит только от zi и m (формула Дебая-Гюккеля), то очевидно, что ионы одной и той же валентности в растворах с одинаковой ионной силой имеют одно и тоже значение коэффициента активности.
 2014-02-04
2014-02-04 599
599








