Адиабатный процесс – это процесс, протекающий без теплообмена с окружающей средой:
dq = 0. (4.25)
Из уравнения первого закона термодинамики следует, что:
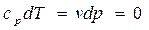 (4.26)
(4.26)
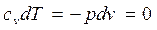 (4.27)
(4.27)
Поделив первое уравнение на второе и учитывая, что 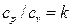 , получим:
, получим:
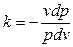 или
или 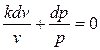 (4.28)
(4.28)
Откуда:
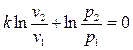 , т. е. (4.29)
, т. е. (4.29)
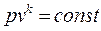 . (4.30)
. (4.30)
Это уравнение является уравнением адиабатного процесса, а k –показателем адиабаты.
Поскольку k > 1, то в рv –координатах линия адиабаты идет круче изотермы.
Для состояния 1 и 2 при адиабатном процессе, учитывая 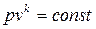 и pv = RT, получим:
и pv = RT, получим:
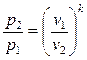 (4.31)
(4.31)
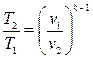 (4.32)
(4.32)
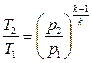 (4.33)
(4.33)
Согласно первому закону термодинамики, работа расширения совершается за счет внутренней энергии, т.е. изменение внутренней энергии газа и работа адиабатного процесса равны по величине и противоположны по знаку:
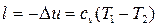 . (4.34)
. (4.34)
С учетом зависимостей 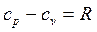 и
и 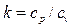 будем иметь:
будем иметь:
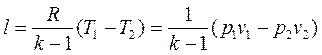 . (4 35)
. (4 35)
Работа l численно равна площади под кривой 1–2 (рисунок 4.4). В данном случае Δ v > 0 и поэтому l > 0.
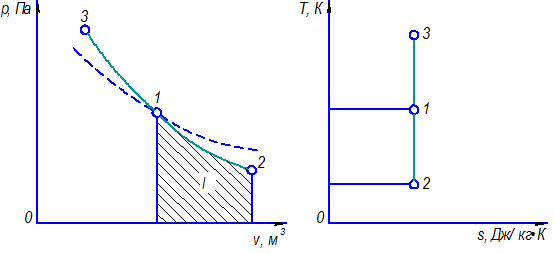
Рис. 4.4 – Изображение адиабатного процесса в pv и Ts – коордитах
Поскольку при адиабатном процессе. dq = 0, то ds = 0, следовательно, s = const. Адиабатный обратимый процесс является изоэнтропным, т.е. протекает при постоянном значении энтропии. На рисунке 4.4 линия 1–2 соответствует расширению рабочего тела (процесс сопровождается уменьшением температуры), а линия 1 –3 – сжатию рабочего тела. Согласно уравнению с = dq/dT, при адиабатном процессе теплоемкость равна нулю.
|
|
|
 2014-02-09
2014-02-09 1681
1681
