Английский физик Т. Эндрюс эксперименгально исследовал зависимость молярного объема углекислого газ от давления при изотермическом сжатии (1866 г.). Результаты этих опытов в виде зависимостей в координатах давление - молярный объем (p-V μ) показаны на рис. 17.2 (Т1 <Т< Т2 <Tк <T3< Т4).
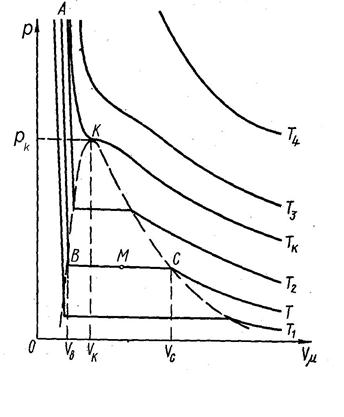
Рис.17.2
1. При температурахниже Т к = 340 К, на каждой изотерме наблюдается горизонтальный участок ВС, вдоль которого постоянным оказывается давление р=рB, а молярный объем может принимать любые значения от Vb до Vc.
2.Разность (Vc – Vb) объемов в конечных точках горизонтальных участков изотерм возрастает с понижением температуры Т. Видно, что эта разность объемов стремится к нулю по мере приближения к температуре Тк, которую называют критической температурой.
3. На изотерме при температуре Т = Тк (критическая изотерма), точки В и С сливаются в одну точку К, называемую критической точкой. Соответствующие ей значения давления р к и молярного объема VK называют критическими.
4. На участке ТС углекислота находится в газообразном состоянии, а на участке ВА - в жидком. На участке СВ углекислота одновременно находится в двух агрегатных состояниях - жидком и газообразном. Точка С соответствует началу конденсации СО2 при изотермическом сжатии, а точка В - концу конденсации.
|
|
|
Наоборот, при изотермическом расширении жидкой углекислоты точка В соответствует началу кипения, а точка С - его концу. Следовательно, точка В соответствует состоянию кипящей жидкости, а точка С - состоянию так называемого сухого насыщенного пара.
В произвольном состоянии М области ВС СО2 представляет собой смесь кипящей жидкости и сухого насыщенного пара. Такую смесь называют влажным паром.
5. Точки «излома» на изотерме определяют набор критических значений тавления.
При давлениях, больших критического, область двухфазного состояния отсутствует. При таких давлениях вещество находится либо в жидком, либо в газообразном состоянии. Границей между ними служит критическая изотерма. Следовательно, газ, температура которого выше критической, нельзя перевести в жидкое состояние путем изотермического сжатия.
Поэтому были неудачными первые попытки сжижения газов, критические температуры которых очень низкие: гелия (T к = 5 К, водорода (T к = 33 K), неона (T к = 44,3K) газов. Причина этого заключается в том, что не были известны их критические температуры, эти газы пытались перевести в жидкое состояние, изотермически сжимая при T > T к.
 2014-02-18
2014-02-18 2267
2267








