Внутренняя энергия Uр реального газа равна сумме кинетической энергии W к хаотического движения молекул и их взаимной потенциальной энергии W n :
Uр = W к + W n (17.11)
Кинетическая энергия W к теплового движения молекул реального газа так же, как и молекул идеального газа, зависит только от абсолютной температуры и молярной теплоемкости газа при постоянном объеме СV:
dW к = n СV dT.
Среднее значение потенциальной энергии газа Ван-дер-Ваальса равно работе, которую нужно затратить против сил притяжения, чтобы разнести все молекулы на бесконечно большие расстояния. Действие сил притяжения учитывается поправкой на внутреннее давление pi. Поэтому потенциальная энергия взаимодействия равна
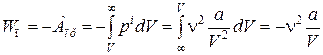 . (17.12)
. (17.12)
Полная внутренняя энергия газа Ван-дер-Ваальса
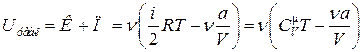 . (17.13)
. (17.13)
Из формулы (17.13) видно, что внутренняя энергия реального газа зависит не только от температуры, но и от объема.
6. Эффект Джоуля − Томсона. Сжижение газов
Эффект Джоуля- Томсона заключается в изменении температуры газа при медленном протекании его под действием постоянного перепада давления сквозь дроссель (рис. 17.7).
Дроссель - препятствие потоку газа (капилляр, вентиль или пористая перегородка, расположенный в трубе на пути потока).
 2014-02-18
2014-02-18 481
481








