Выражение (18.3) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
При конечном изменении объема работа должна вычисляться как сумма элементарных работ, т. е.
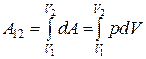 . (18.3)
. (18.3)
Согласно закону сохранения энергииработа, совершаемая системой, равна разности между количеством теплоты, сообщаемой системе и изменением ее внутренней энергии
A = Q – D U. (18.4)
или
Q = A + D U. (18.5)
Это уравнение является математической записью первого закона термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение системой работы против внешних сил. В дифференциальной форме первое начало термодинамики имеет вид:
d Q = d A + D U. (18.6)
3.Понятие теплоемкости
Теплоемкостью какого-либо тела называется величина, равная количеству теплоты, которое нужно сообщить телу, чтобы повысить его температуру на один Кельвин
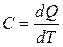 . (18.7)
. (18.7)
Единица измерения теплоемкости [Дж/К].
Теплоемкость моля вещества называется молярной теплоемкостью - величина, равная количеству теплоты, необходимому для нагревания одного моля вещества на один Кельвин:
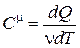 . (18.8)
. (18.8)
Единица измерения молярной теплоемкости – Дж/моль · К.
Теплоемкость единицы массы вещества называется удельной теплоемкостью - величина, равная количеству теплоты, необходимому для нагревания одного килограмма вещества на один Кельвин:
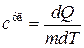 . (18.9)
. (18.9)
Единица измерения удельной теплоемкости [Дж/кг · К].
Если разделим (18.8) на (18.9), то получим соотношение между молярной и удельной теплоемкостями одного и того же вещества
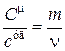 Þ
Þ 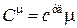 , (18.10)
, (18.10)
где 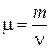 - молярная масса вещества.
- молярная масса вещества.
Величина теплоемкости зависит от условий, при которых происходит нагревание тела. Если нагревание происходит при постоянном объеме, то теплоемкость называется теплоемкостью при постоянном объеме и обозначается .
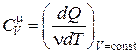 и
и 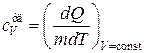 . (18.11)
. (18.11)
Если процесс передачи тепла происходит при постоянном давлении, то теплоемкость называется теплоемкостью при постоянном давлении и обозначается
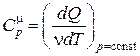 и
и 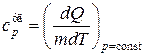 . (18.12)
. (18.12)
4. Применение первого начала термодинамики
к идеальному газу. Формула Майера
Получим выражения для теплоемкости и работы при различных процессах над идеальным газом.
Изохорический процесс. Если газ нагревается или охлаждается при постоянном объеме (рис.18.2), то dV = 0 и работа внешних сил равна нулю
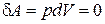 Þ
Þ 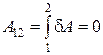 .
.
Сообщаемая газу извне теплота пойдет только на увеличение его внутренней энергии, т. е.
d Q = dU + d A Þ d Q = dU. (18.13)
С учетом выражения (18.11)
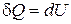 Þ
Þ 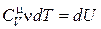 или
или 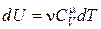 . (18.14)
. (18.14)
Изменение внутренней энергии газа определятся соотношением
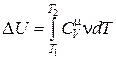 . (18.15)
. (18.15)
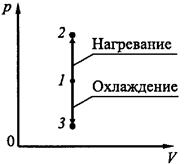
Рис.18.2
Если 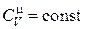 (что справедливо для идеального газа), то соотношение (18.15) можно записать в виде
(что справедливо для идеального газа), то соотношение (18.15) можно записать в виде
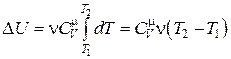 . (18.16)
. (18.16)
Получим выражения для молярной и удельной теплоемкостей идеального газа при постоянном объеме. Чтобы получить формулу для изменения внутренней энергии идеального газа, применим соотношение (2.6)
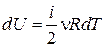 . (18.17)
. (18.17)
Подставим выражение (18.17) в (18.14) и выразим 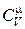
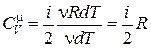 . (18.18)
. (18.18)
Удельная теплоемкость равна
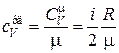 . (18.19)
. (18.19)
Изобарический процесс, p = const. Работа, совершаемая газом при изобарическом процессе (рис.18.3) равна
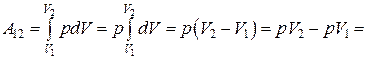
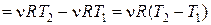 . (18.20)
. (18.20)
Первое начало термодинамики запишем в следующем в виде
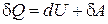 Þ
Þ 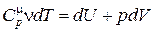 . (18.21)
. (18.21)
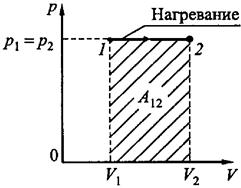
Рис.18.3
Продифференцировав уравнение Клапейрона– Менделеева при условии что p = const, получим
pdV = n RdT. (18.22)
Подставим выражение (18.22) в (18.21)
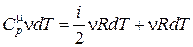 . (18.23)
. (18.23)
Молярная теплоемкость идеального газа при постоянном давлении равна
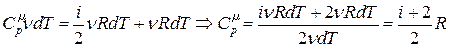 . (18.24)
. (18.24)
Удельная теплоемкость равна
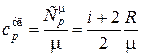 . (18.25)
. (18.25)
Из уравнений (18.24) и (18.25) можно получить соотношение между молярными теплоемкостями постоянном давлении и постоянном объеме, которое получило название формулы Майера
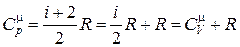 . (18.26)
. (18.26)
Изотермический процесс (T = const). Работа равна
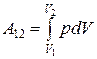 .
.
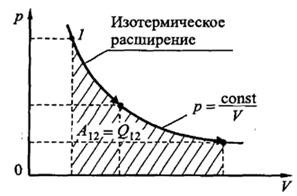
Рис.18.4
Выразив давление из уравнения Клапейрона– Менделеева 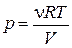 и подставив в последнюю формулу, получим выражение для работы, совершаемой газом при изотермическом процессе
и подставив в последнюю формулу, получим выражение для работы, совершаемой газом при изотермическом процессе
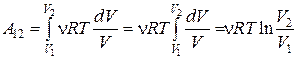 . (18.27)
. (18.27)
Так как для идеального газа при T = const dU = 0, то первое начало термодинамики можно записать в следующем виде
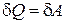 Þ
Þ 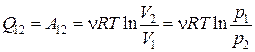 . (18.28)
. (18.28)
5. Адиабатический процесс. Вывод уравнения
адиабатического процесса
Адиабатическим н азывается процесс, протекающий без теплообмена с окружающей средой. Получим уравнение адиабатического процесса для идеального газа. Так как по условию d Q = 0, то первое начало термодинамики можно записать в виде
d Q = dU + d A Þ d A = – dU. (18.29)
Из (18.29) следует, что работа газа при адиабатическом процессе выполняется за счет убыли его внутренней энергии. Учитывая, что 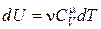 , а d A = pdV, получим
, а d A = pdV, получим
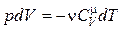 . (18.30)
. (18.30)
Выразим из уравнения Клапейрона– Менделеева давление 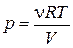 и подставим в (18.30)
и подставим в (18.30)
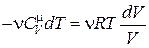 Þ
Þ 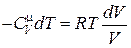 . (18.31)
. (18.31)
Приведем (18.31) к виду
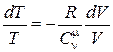 . (18.32)
. (18.32)
Проинтегрируем (18.32) от Т 1 до T 2, и от V 1 до V 2:
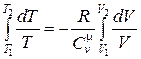 Þ
Þ 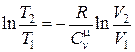 , (18.33)
, (18.33)
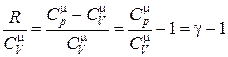 Þ
Þ 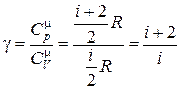 , (18.34)
, (18.34)
где отношение теплоемкостей 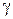 получило название адиабатической постоянной.
получило название адиабатической постоянной.
Используя первое равенство в (18.34), выражение (18.33) можно переписать в виде:
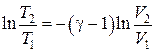 Þ
Þ 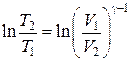 Þ
Þ
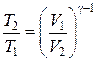 Þ
Þ 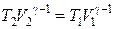 . (18.35)
. (18.35)
или
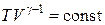 . (18.36)
. (18.36)
Преобразуем (18.36) к переменным p, V. Для этого выразим из уравнения Клапейрона– Менделеева температуру: 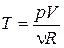 и подставим в уравнение (18.36)
и подставим в уравнение (18.36)
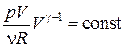 Þ
Þ 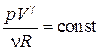 . (18.37)
. (18.37)
Учитывая, что n и R – постоянные, получим
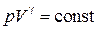 . (18.38)
. (18.38)
Выражение (18.38) получило название уравнения Пуассона. График зависимости p (V), который описывается уравнением (18.38), называется адиабатой (рис.18.5).
Определим работу, совершаемую газом при адиабатическом процессе, которая численно равна заштрихованной площади на рис.18.5. Так как при адиабатическом процессе d A = – dU, то учитывая, что 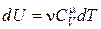 , получим
, получим
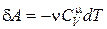 . (18.39)
. (18.39)
Проинтегрировав полученное выражение от T 1 до T 2, получим:
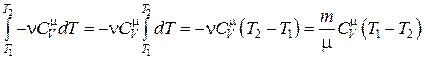 . (18.40)
. (18.40)
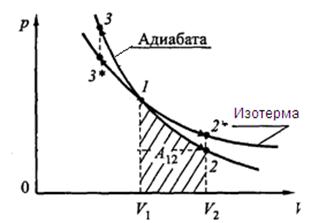
Рис.18.5
 2014-02-18
2014-02-18 617
617








