II. Галогенирование ароматических соединений (Аренов)
I. Общие сведения
Методы получения органических галогенидов в химической технологии БАВ
Методов получения органических галогенидов много.Кроме собственно «галогенирования» - процесса замены атома водорода в молекуле органического соединения на галоген – используются много других методов, которые приводят к образованию связи C-Hlg. Выбор метода и условий проведения реакции зависит как от природы субстрата, так и от природы вводимого галогена.
Органическиегалогениды химически активны и широко используются в синтезе новых соединений, в том числе и БАВ.
Все они биологически активны: галогениды алифатического ряда обладают наркотическими свойствами, а арилгалогениды часто проявляют антимикробные свойства. В связи с этим, в состав молекулы многих лекарственных соединений входит один или несколько атомов галогена (хлороформ, хлоралгидрат, бромизовал, дииодтирозин, левомицетин, фторурацил и т.д.). Биологическую активность галогенидов связывают, с одной стороны, с их высокой растворимостью в жировых тканях и липидах и, с другой стороны, с высокой химической активностью (в частности, алкилирующей).
Увеличение числа атомов галогена в молекуле соединения, как правило, приводит к увеличению его токсичности.
2.1. Механизм галогенирования аренов SE атома воторода.
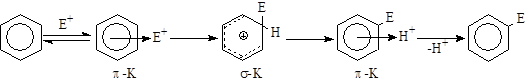
1) Строение арена. Электронодонорные заместители в ароматическом кольце стабилизируют s-комплекс, ускоряют процесс и направляют галоген в орто- и пара-положение, электроноакцепторные - дестабилизируют s-комплекс, замедляют процесс и направляют галоген в мета-положение.
Относительные скорости бромирования аренов формулы PhZ:
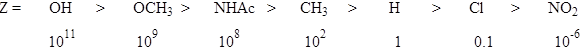 При этом необходимо учитывать условия реакции. Например, если протонировать гидроксильную группу в феноле или амино – в амине, то скорость реакции будет мала, а замещение пойдет в мета -положение, наоборот в щелочной среде активность фенола возрастает на несколько порядков:
При этом необходимо учитывать условия реакции. Например, если протонировать гидроксильную группу в феноле или амино – в амине, то скорость реакции будет мала, а замещение пойдет в мета -положение, наоборот в щелочной среде активность фенола возрастает на несколько порядков:
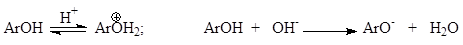
2) Активность электрофильной частицы в большой степени определяется природой галогена и катализатором.
- Природа галогена влияет на активность электрофильной частицы настолько сильно, что практическое значение в основномимеют реакции прямого хлорирования и бромирования аренов.
Прямое фторирование не используется вследствие очень высокой экзотермичности процесса. Иодирование обратимо, идет очень медленно и требует активации. Поэтому реакцию часто проводят в присутствии окислителей, которые реагируют с выделяющимся иодоводородом либо повышают электрофильность молекулярного иода, окисляя его до IÅ.
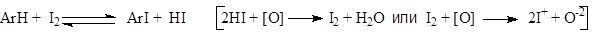
- Катализаторами процесса галогенирования чаще всегоявляются а) кислоты Льюиса (FeCl3 и др.), б) концентрированная серная кислота, в) иод, г) среда. Они влияют не только на скорость, но и на направление процесса. Удачный подбор катализатора может обеспечить высокую селективность процесса. Так, например, при бромировании хлорбензола в присутствии хлорида алюминия или ацетат таллия (III) получается почти исключительно пара -изомер:
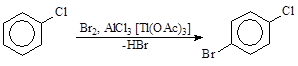
а) Катализ кислотами Льюиса. В промышленности чаще всего реакцию проводят в присутствии галогенида железа (III), который, как правило, получают прямо в реакционной массе при добавлении в нее железа.
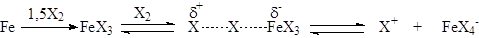
При хлорировании аренов в этих условиях электрофильной частицей является хлорид-катион. При бромировании в случае использования FeBr3 и других мало активных кислот Льюиса, основной атакующей частицей является поляризованный комплекс, например:
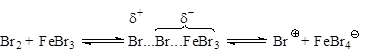
Образование катиона галогена идет в незначительной степени.
б) Катализ серной кислотой:
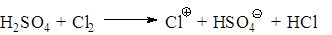
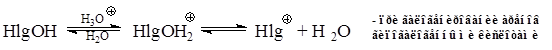
в) Катализ иодом:
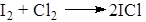
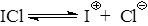
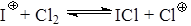
При использовании каталитических количеств иода идет хлорирование, так как образуется катион СlÅ, а при соотношениях близких к эквимолекулярным – иодирование, так как образуется IÅ.
г) Каталитическое влияние растворителя. Роль электрофильной частицы может выполнять и поляризованная молекула. Степень её поляризации зависит от полярности растворителя. В связи с этим галогенирование активных субстратов (ароматических аминов, фенолов, полиалкилбензолов типа мезитилена, нафталина, и т.п.) молекулярным хлором и бромом возможно и без катализатора.
В воде при комнатной температуре амины и фенолы образуют тригалогенпроизводные. Монозамещенные фенолы можно получить лишь при очень низкой температуре (-70°С) и неполярном растворителе. Бромирование фенолов в этом случае идет исключительно в о-положение. Для моногалогенирования первичных аминов их предварительно ацилируют по аминогруппе.
Растворитель влияет на скорость реакции не только активируя галоген, но и сольватируя субстрат и промежуточные соединения.Согласно теории Хьюза-Ингольда, полярные растворители ускоряют реакции, в которых s-комплекс поляризован больше, чем реагенты (бромирование фенола), а неполярные или малополярные - реакции, в которых, наоборот, s-комплекс менее поляризован, чем исходные реагенты (хлорирование бензола).
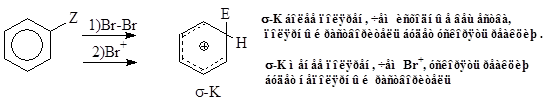
При выборе растворителя следует учитывать также чисто технологические соображения (токсичность, взрыво-, пожароопасность, агрессивность). Так, наличие воды в реакционной массе при галогенировании аренов приводит к образованию соответствующей галогеноводородной кислоты, которая вызывает коррозию оборудования.
3) Концентрация реагирующих веществ. Чем она выше, тем быстрее идет реакция. Однако необходимо помнить, что в промышленных процессах, как правило, один из реагентов взят в избытке.
4) Температура процесса галогенирования арена может быть самой разной (от –70 до 300 ° С) и зависит от субстрата и природы галогена.
Реакция хлорирования в ядро, как правило, протекает быстро и с выделением большого количества тепла, поэтому в большинстве случаев реакционную массу охлаждают. Тепловой эффект бромирования значительно меньше, в этих случаях её подогревают. Эндотермическая реакция иодирования всегда идет при нагревании.
Повышение температуры с целью увеличения скорости реакции необходимо осуществлять очень осторожно после детального изучения процесса. Даже незначительное повышение температурыможет существенно ускорить реакцию и привести к образованию большого количества полигалогензамещенных. Резкое изменение её может привести к изменению направления реакции. Причиной этого может быть переход от гетеролитического механизма к гомолитическому. Так, пиридин при 300°С (пемза) бромируется в положение 3, а при 500°С – в положение 2.
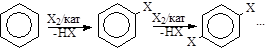
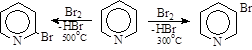
Поэтому для достижения желаемого результата строго выдерживают заданную температуру процесса.
 2014-02-18
2014-02-18 2388
2388







