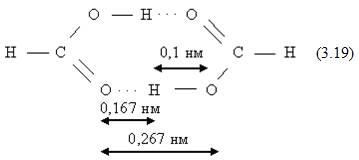
Водородная связь. Эта связь осуществляется между атомом водорода, химически связанном с одной молекулой и электроотрицательными атомами О, N, F, Cl и другими, принадлежащими той же или другой молекуле. В первом случае это будет внутримолекулярная связь, во втором – межмолекулярная. Природа водородной связи сложна и не сводится только к электростатическому притяжению, хотя оно дает основной вклад в энергию водородной связи. По данным структурного анализа кристаллов, расстояние между электроотрицательными атомами, связанными водородной связью, меньше ван-дер-ваальсовых радиусов соответствующих атомов. Например, сумма ван-дер-ваальсовых радиусов для пары атомов О ∙ ∙ ∙ О составляет 0,28 нм, а при образовании водородной связи О – Н ∙ ∙ ∙ О это расстояние сокращается до 0,27 – 0,25 нм. В димере уксусной кислоты (19) расстояние О – Н в гидроксигруппе равно 0,1 нм, длина водородной связи составляет 0,167 нм. Теплота димеризации муравьиной кислоты 59,22 кДж/моль, следовательно, на энергию водородной связи приходится 59,22/2 = 29,61 кДж/моль.
Наряду с электростатическим взаимодействием, ван-дер-ваальсовым притяжением и отталкиванием в энергию водородной связи UВОДОР вносит вклад и энергия делокализации UДЕЛОК двух электронов связи (А – Н) и неподеленной пары электронов другого электроотрицательного атома (В), что также уменьшает ее длину. Например, для связи О – Н ∙ ∙ ∙ О UВОДОР = UЭЛ-СТАТ + UДИСП + UДЕЛОК + UОТТ, что дает соответственно UВОДОР = (– 25,2 – 12,6 – 33,6 + 35,28) = – 36,12 кДж/моль.
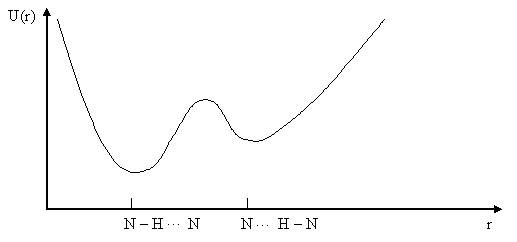
Рис. 3.4. Потенциальная функция водородной связи с двумя минимумами.
Как правило, значения энергии водородной связи лежит в пределах 12,6 – 33,6 кДж/моль. Экспериментальные данные показали, что потенциальная функция водородной связи имеет вид асимметричной кривой связи вдоль прямой линии, соединяющей атомы. Это кривая с двумя минимумами (рис.3.4.), локализованными вблизи электроотрицательных атомов.
Электростатическое (заряд-дипольное) взаимодействие. Этот вид взаимодействий не только дает вклад в энергию водородных связей, но и играет важную самостоятельную роль в стабилизации биоструктур. Различные атомы в пептидных цепочках сильно различаются по характеру распределения на них зарядов. Взаимодействие частично заряженных атомов характеризуется электростатическим потенциалом:
qi ∙ qj
UЭЛ-СТАТ = ————, (3.20)
ε ∙ rij
где: qi, qj – величины парциальных зарядов на атомах (i, j); rij – расстояние между атомами; ε – диэлектрическая постоянная, зависящая от поляризуемости атомов и их взаимного расположения (значение ее обычно принимается равным ~ 3,5). Величины парциальных зарядов на атомах определяются методами квантовой химии.
Учет электростатических взаимодействий наряду с ван-дер-ваальсовыми силами несколько изменяет расстояния между атомами и их стерическое положение в структуре биополимеров. Представление о точечной локализации зарядов на атомных центрах не позволяет учесть закономерности, связанные с объемным распределением зарядовой плотности. Сравнение зависимости энергии от расстояния для точечных зарядов и 1 s – электронных облаков атома водорода показывает совпадение на расстоянии 0,175 – 0,2 нм. То есть для атома водорода точечное приближение оправдано на расстояниях, составляющих 60-70 % от суммы ван-дер-ваальсовых радиусов.
 2014-02-18
2014-02-18 1745
1745
