Связи, при образовании которых перестройка электронных оболочек не происходит, называются взаимодействием между молекулами. К основным видам взаимодействия молекул следует отнести вандерваальсовы силы, водородные связи и донорно-акцепторное взаимодействие.
При сближении молекул появляется притяжение, что обуславливает возникновение конденсированного состояния вещества (жидкого, твердого с молекулярной кристаллической решеткой). Силы, которые способствуют притяжению молекул, получили название вандерваальсовых. Они характеризуются тремя видами межмолекулярного взаимодействия:
а) ориентационное взаимодействие, которое проявляется между полярными молекулами, стремящимися занять такое положение, при котором их диполи были бы обращены друг к другу разноименными полюсами, а векторы моментов этих диполей были бы ориентированы по одной прямой (по-другому оно называется диполь-дипольное взаимодействие);
б) индукционное, которое возникает между индуцированными диполями, причина образования которых является взаимная поляризация атомов двух сближающихся молекул;
в) дисперсионное, которое возникает в результате взаимодействия микродиполей, образующихся за счет мгновенных смещений положительных и отрицательных зарядов в молекулах при движении электронов и колебаний ядер.
Дисперсионные силы действуют между любыми частицами. Ориентационное и индукционное взаимодействие для частиц многих веществ, например: He, Ar, H2, N2, CH4, не осуществляется. Для молекул NH3 на дисперсионное взаимодействие приходится 50 %, на ориентационное – 44,6 % и на индукционное – 5,4 %. Полярная энергия вандерваальсовых сил притяжения характеризуется невысокими значениями. Так, для льда она составляет 11 кДж/моль, т.е. 2,4 % энергии ковалентной связи H-O (456 кДж/моль). Вандерваальсовы силы притяжения – это физические взаимодействия.
Водородная связь – это физико-химическая связь между водородом одной молекулы и ЭО элементом другой молекулы. Образование водородных связей объясняется тем, что в полярных молекулах или группах поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой ЭО и очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома. Как показывают спектральные данные, в образовании водородной связи существенную роль играет также и донорно-акцепторное взаимодействие ЭО атома как донора и атома водорода как акцептора. Водородная связь может быть межмолекулярной или внутримолекулярной.
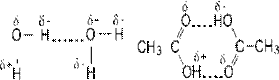 |
| Водородная связь изображена точками |
Для соединений фтора и кислорода характерно образование за счет водородной связи группировок из одинаковых молекул – ассоциатов (H2O)n и (HF)m. Это сказывается на целом ряде свойств соединений, особенно на таких параметрах, как температура кипения (tкип) и замерзания (tзам). По относительной величине молекулярных масс H2O и H2S для воды tкип и tзам должны быть ниже, чем для сульфида водорода (60,75 и -85,60 °С).
В действительности они выше (100 и 0 °С), что связано с увеличением молярной массы воды за счет ассоциации ее молекул. Карбоновые кислоты в жидкой и газовой фазах существуют в основном в виде димеров. В белках, нуклеиновых кислотах и других органических соединениях, имеющих большое биологическое значение, водородная связь обеспечивает «сшивание» цепочечных молекул. Для некоторых соединений возможно также образование внутримолекулярной водородной связи, например в нитрофеноле. Длина водородной связи больше длины ковалентных связей. В ряде соединений типа RA-H…BR’ при сокращении равновесного расстояния Н-В длина связи А-Н увеличивается, и в предельном случае обе связи могут оказаться одинаковыми, как в дифторид-ионе (FHF)-.
Энергия водородной связи (8 - 40 кДж/моль) ниже энергии ковалентной связей. Так, для льда она равна 20 кДж/моль, что составляет 4,3 % энергии ковалентной связи Н-О, равной 456 кДж/моль. Наибольшее значение энергии водородной связи имеют соединения фтора (25 - 40 кДж/моль), затем кислорода (13 - 25 кДж/моль) и азота (8 - 21 кДж/моль). Для серы и хлора образование водородных связей нехарактерно. Энергия водородных связей возрастает с увеличением ЭО элементов и уменьшением размеров атомов. Образование межмолекулярных водородных связей приводит к повышению вязкости, диэлектрической постоянной, температуры кипения и плавления (замерзания), теплот плавления и парообразования, образованию ассоциатов.
Если водородные связи образуются внутри молекул, то понижается вязкость, температура кипения и плавления, эти вещества боле летучи, не образуют ассоциаты, водородные связи внутри молекул приводят к поперечному сливанию цепочечных молекул. Таким образом, водородная связь занимает промежуточное положение между ковалентной и вандерваальсовой силами притяжения.
Донорно-акцепторное взаимодействие, как отмечалось ранее, приводит к образованию ковалентной полярной связи, т.е. относится к химическим видам взаимодействия. Донорно-акцепторное взаимодействие объясняет образование комплексных соединений. Например, при взаимодействии сульфата меди и аммиака образуется сложное соединение:
СuSO4 + 4NH3 = CuSO4.4NH3,
которое выражается формулой [Сu(NH3)4]SO4. Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных или координационных соединений.
Согласно координационной теории А. Вернера, комплексные соединения состоят из двух сфер: внешней и внутренней. В приведенном выше примере внешней сферой является ион SO42-. Внутренняя сфера называется комплексом, включает центральный ион или атом, который называется комплексообразователем (Cu2+). Вокруг него координируются отрицательно заряженные ионы или нейтральные молекулы (называются лигандами (NH3)). Число лигандов, координируемых комплексообразователем, называют координационным числом.
В зависимости от заряда различают анионные комплексы, например [PF6]-, [Zn(CN)4]2-, [Al(OH)4]-, катионные комплексы, например [Cu(NH3)4]2+, [Ni(CO)4] и [Pt(NH3)2Cl2]. Нейтральные комплексы не имеют внешней сферы. Заряд комплекса численно равен алгебраической сумме заряда центрального иона и заряда лигандов. Например, заряд Z комплекса [Zn(CN)4]2- равен
Z = ZZn2+ + 4ZCN- = 2 + 4(-1) = -2.
Таким образом, имеется обширный класс соединений, называемых комплексными, в которых существуют ковалентные связи, образованные по донорно-акцепторному механизму между центральным атомом или ионом (комплексообразователем-акцептором) и координируемыми им лигандами, имеющими неподеленные пары электронов (донорами).
 2014-02-12
2014-02-12 14602
14602
