Согласно молекулярно-кинетическим представлениям любое тело состоит из мельчайших частиц, называемых молекулами. Эти частицы находятся в беспорядочном, хаотическом движении, интенсивность которого зависит от температуры тела. Такое движение молекул называется тепловым.
Основные положения молекулярно-кинетической теории:
• Все вещества состоят из мельчайших частиц – атомов и молекул, т. е. вещества имеют дискретное (прерывистое) строение.
• Молекулы и атомы любого вещества (жидкого, твердого и газообразного) находятся в непрерывном хаотическом (тепловом) движении. При нагревании вещества интенсивность движения частиц увеличивается.
Опытное обоснование основных положений :
| 1. Проницаемость, сжимаемость, растворимость, наблюдение молекул и атомов в электронных микроскопах 2. Способность газов неограниченно расширяться, наблюдение броуновского движения, диффузия 3. Прочность, упругость тел, смачивание, поверхностное натяжение в жидкости | Молекулярное строение вещества Тепловое движение Силы взаимодействия между молекулами |
Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, содержащей столько же частиц, сколько содержится атомов в 0,012 кг углерода 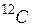 .
.
Отношение числа молекул N к количеству вещества 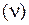 называется постоянной Авогадро
называется постоянной Авогадро 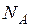 :
:
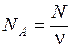 (8.1)
(8.1)
Постоянная Авогадро равна 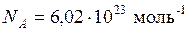 , она показывает, сколько атомов или молекул содержится в одном моле вещества.
, она показывает, сколько атомов или молекул содержится в одном моле вещества.
Количество вещества 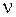 можно найти как отношение числа N атомов или молекул вещества к постоянной Авогадро
можно найти как отношение числа N атомов или молекул вещества к постоянной Авогадро 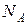 :
:
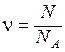 . (8.2)
. (8.2)
Молярной массой 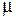 называется величина, равная отношению массы вещества m к количеству вещества
называется величина, равная отношению массы вещества m к количеству вещества 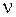 :
:
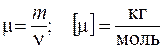 (8.3)
(8.3)
Равновесные состояния термодинамической системы часто описывают уравнениями состояния, связывающими параметры состояния:
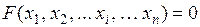 , (8.4)
, (8.4)
где 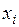 – параметры состояния.
– параметры состояния.
В простейшем случае равновесное состояние тела определяется значениями трех параметров p, V, T, тогда уравнение состояния имеет вид
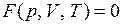 (8.5)
(8.5)
Температура — это физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы и определяющая направление теплообмена между телами.
В международной практической шкале температура градуируется в градусах Цельсия (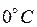 ). В физике чаще пользуются термодинамической температурой. Единица термодинамической температуры – кельвин (К) является одной из основных единиц СИ. Числовые значения кельвина и градуса одинаковы. Они связаны соотношением
). В физике чаще пользуются термодинамической температурой. Единица термодинамической температуры – кельвин (К) является одной из основных единиц СИ. Числовые значения кельвина и градуса одинаковы. Они связаны соотношением
T = t + 273,15. (8.6)
Температура, равная 0 К, называется абсолютным нулем температуры; ему соответствует 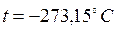 . Температуре
. Температуре 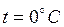 соответствует
соответствует 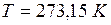 .
.
Газ считается идеальным, если в рассматриваемых условиях он подчиняется следующим требованиям:
• Объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
• Между молекулами газа отсутствуют силы взаимодействия;
• Столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Существуют в действительности газы (водород, гелий, кислород, воздух и т. д.), которые в условиях близких к нормальным (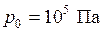 , T = 273 K), хорошо описываются моделью идеального газа. Напротив, водяной пар и СО2 при таких же условиях существенно отличаются от модели идеального газа.
, T = 273 K), хорошо описываются моделью идеального газа. Напротив, водяной пар и СО2 при таких же условиях существенно отличаются от модели идеального газа.
Уравнение состояния идеального газа основано на эмпирических законах Бойля, Мариотта и Гей-Люссака. Оно имеет вид
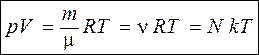 . (8.7)
. (8.7)
Здесь p – давление; V – объем; T – температура; m – масса; 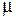 – масса одного моля;
– масса одного моля; 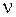 – количество вещества; N – число молекул; R – универсальная газовая постоянная; k – постоянная Больцмана. Это есть уравнение КлапейронаМенделеева для массы m газа. Эти постоянные связаны соотношением
– количество вещества; N – число молекул; R – универсальная газовая постоянная; k – постоянная Больцмана. Это есть уравнение КлапейронаМенделеева для массы m газа. Эти постоянные связаны соотношением
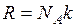 , (8.8)
, (8.8)
где 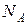 – число Авогадро. Их значения равны:
– число Авогадро. Их значения равны: 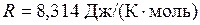 ;
; 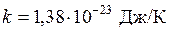 .
.
 2014-02-24
2014-02-24 1554
1554
