Изопроцессы — это равновесные процессы, в которых один из основных параметров сохраняется постоянным.
Изобарный процесс — это процесс, протекающий при постоянном давлении (p= const).
Диаграмма этого процесса (изобара) в координатах p, V изображается прямой, параллельной оси V (рис. 9.4.). При изобарном процессе работа газа при увеличении объема от V1 до V2
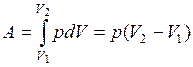 (9.15)
(9.15)
и определяется площадью закрашенного прямоугольника. Используя уравнение Клапейрона 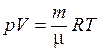 , получаем
, получаем
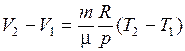 . (9.16)
. (9.16)
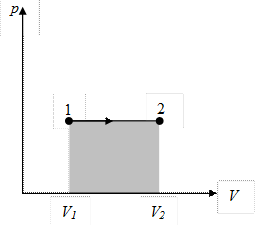
Рис. 9.4
Поэтому работа изобарного расширения
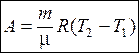 . (9.17)
. (9.17)
В изобарном процессе при сообщении газу массой m количества теплоты
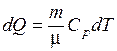 (9.18)
(9.18)
его внутренняя энергия возрастает на величину
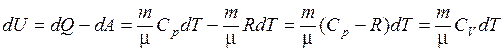 .
.
Итак,
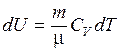 . (9.19)
. (9.19)
Изохорный процесс— это процесс, протекающий при постоянном объеме (V=const). Диаграмма этого процесса (изохора) в координатах p, V изображается прямой, параллельной оси ординат (на рис. 9.5.процесс 1–2 – изохорное нагревание). В изохорном процессе газ над внешними телами работы не совершает:
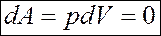 . (9.20)
. (9.20)
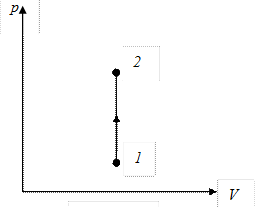
Рис. 9.5
Из первого начала термодинамики 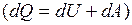 для изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии:
для изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии: 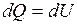 .
.
Согласно формуле (9.9) 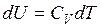 . Тогда для произвольной массы газа
. Тогда для произвольной массы газа
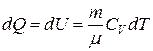 . (9.21)
. (9.21)
Изотермический процесс — это процесс, протекающий при постоянной температуре (T = const). Диаграмма этого процесса (изотерма) в координатах p, V изображается гиперболой (pV=const), (рис. 9.5). Учитывая, что 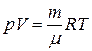 , работа изотермического расширения газа есть:
, работа изотермического расширения газа есть:
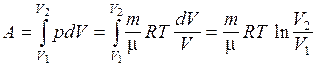 .
.
Итак,
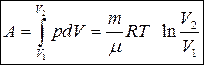 . (9.22)
. (9.22)
Из первого начала термодинамики  следует, что в изотермическом процессе
следует, что в изотермическом процессе 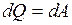 , т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
, т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
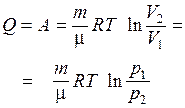 (9.23)
(9.23)
Чтобы при работе расширения температура не уменьшалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
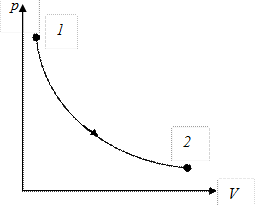
Рис. 9.6
Адиабатный процесс – это такой процесс, при котором отсутствует теплообмен между системой и окружающей средой (dQ = 0).
Из первого начала термодинамики 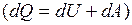 для адиабатического процесса следует, что
для адиабатического процесса следует, что 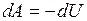 , т. е. внешняя работа совершается за счет изменения внутренней энергии системы. Перепишем это уравнение с учетом того, что
, т. е. внешняя работа совершается за счет изменения внутренней энергии системы. Перепишем это уравнение с учетом того, что 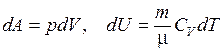 :
:
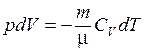 . (9.24)
. (9.24)
Возьмем полный дифференциал от левой и правой частей уравнения 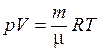 :
:
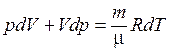 . (9.25)
. (9.25)
Разделив уравнение (9.25) на (9.24) и учитывая, что 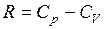 и
и 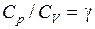 есть показатель адиабаты (9.14), найдем
есть показатель адиабаты (9.14), найдем
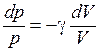 . (9.26)
. (9.26)
Интегрируя это уравнение в пределах от p 1 до p 2 и соответственно от V 1 до V 2, а затем потенциируя, придем к выражению
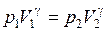 . (9.27)
. (9.27)
Состояния (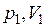 ) и (
) и (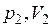 ) произвольны, поэтому искомое уравнение:
) произвольны, поэтому искомое уравнение:
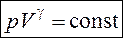 . (9.28)
. (9.28)
Уравнение (9.28) называется уравнением Пуассона.
Используя уравнение Клапейрона-Менделеева 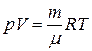 , можно из уравнения Пуассона найти связь между p и T, а также V и T в адиабатическом процессе:
, можно из уравнения Пуассона найти связь между p и T, а также V и T в адиабатическом процессе:
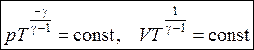 . (9.29)
. (9.29)
Диаграмма адиабатного процесса (адиабата) в координатах p, V изображается гиперболой, правда, более крутой, чем изотерма (см. рис. 9.7). Это объясняется тем, что при адиабатном сжатии 1-3 увеличение p обусловлено не только уменьшением V (как при изотермическом процессе), но и повышением Т.
Вычислим работу газа в адиабатном процессе. Из равенств 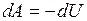 ,
, 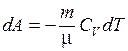 , получим
, получим
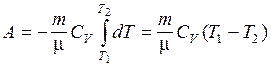 . (9.30)
. (9.30)
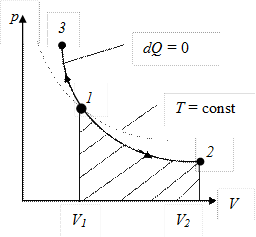
Рис. 9.7
Работа адиабатного расширения 1–2 (на рис. 9.7 определяется заштрихованной площадью) меньше, чем в изотермическом процессе. При адиабатном расширении температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
В табл. 9.1 приведены сводные данные о характеристиках изопроцессов в газах.
 2014-02-24
2014-02-24 1414
1414








