В качестве ионита применяют также фильтровальную или хроматографическую бумагу, иногда вату, т. е. целлюлозу, представляющую собой полимер состава:
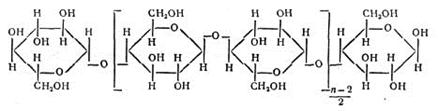
Водородные ионы карбоксильных групп способны обмениваться на катионы металлов. Бумагой нельзя пользоваться для полного выделения и концентрирования катионов из растворов. Однако, обменная емкость материалов из целлюлозы значительно повышается (в 8 — 10 раз), если ее предварительно окислить, т. е. получить так называемую окси-целлюлозу. Оксиды азота, хлор, бром, другие окислители окисляют целлюлозу. Оксицеллюлозу можно приготовить погружением бумаги в азотную кислоту, после чего бумагу промывают водой. Другой способ получения оксицеллюлозы заключается в промывании гигроскопической ваты 20% -ной соляной кислотой, затем дистиллированной водой. Промытую вату вносят в раствор гипобромита натрия (т.е. раствор NaOH + Br2). Через некоторое время вата расщепляется на тонкие нити, которые промывают водой, затем соляной кислотой и снова водой, после чего высушивают при 90° С. Длина полученных волокон оксицеллюлозы — 0,5 — 1 мм, толщина около 0,01 мм. Оксицеллюлоза очень хороший сорбент для концентрирования многих катионов.Из бумаги, окисленной указанным способом, вырезают диск диаметром 8 мми закрепляют его в приборе, схема которого показана на рис.
|
Сначала в кювету наливают небольшой объем раствора карбоната натрия (рН=8). Когда весь раствор пройдет через фильтр, вводят 10 мл природной воды, исследуемой на присутствие небольших количеств никеля. При прохождении воды через фильтр, на последнем сорбируется практически весь никель. Бумажный диск затем извлекают из прибора и погружают в 0,1%-ный этанольный раствор диметилглиоксима, подщелоченный раствором аммиака. При наличии даже 10~9 гникеля во взятых 10 млводы, т.е. при концентрации около 10-9 моль!л, диск приобретает заметную розовую окраску, по интенсивности которой судят о содержании никеля в пробе.
Анализируемую пробу (1 —10 л ) с рН 5—6 взбалтывают с 3 мгмелкоизмельченной оксицеллюлозы и волокна с сорбированными на них ионами, помещают на пористую стеклянную пластинку диаметром 5 мм и отсасывают (на воронке Бюхнера). Получают диск из волокон, на которых идентифицируют сорбированные ионы при помощи известных цветных реакций. Таким путем удается выделить ряд ионов из проб воды с концентрацией до 1: 109. Указанное количество оксицеллюлозы способно поглотить по 10-5 г Ag+, Cd2+, Ba2+; по 10-6 г А13+, Fe3+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+, Pb2+. Разные ионы задерживаются оксицеллюлозой при разных значениях рН.
| рН | Концентрируемые ионы |
| Fe3+, Bi3+ | |
| А13+, Cr3+, Mn2+, Fe2+, Cu2+, VO2+, Cd'2+, Ba2+, UO2+ | |
| РЬ2+ | |
| Co2+, Ni2+, Zn2+ | |
| Ag+, Hg2+ |
Максимальная адсорбция (обмен Меп+) находится при значениях рН, близким к рН осаждения соответствующего гидроксида металла. Для полного извлечения иона иногда требуется повторная обработка раствора свежей порцией оксицеллюлозы. Способность целлюлозы задерживать катионы металлов объясняется не только ионным обменом, но и чисто адсорбционными процессами. Именно поэтому измельченная целлюлоза поглощает большее количество тех или иных катионов, чем неизмельченная.
Катионы, задержанные целлюлозой и оксицеллюлозой, не удаляются промыванием водой, но могут быть выделены обработкой кислотой.
В некоторых случаях нейтральный исследуемый раствор фильтруют через бумагу, пропитанную раствором сульфида цинка, при этом на бумаге задерживаются Cu2+, Pb2+ и другие катионы, которые обнаруживаются по появлению желтой или коричневой окраски.
Концентрирование на стеклянной вате. Этот способ концентрирования основан на том, что на сильноразвитой удельной поверхности стеклянной ваты могут сорбироваться многие ионы. Поверхность 1 г стеклянной ваты достигает 2,5 м 2 и более.
|
Исследуемый водный раствор, содержащий ионы железа, подкисляют соляной кислотой (рН<1), обрабатывают перекисью водорода или бромной водой для окисления Fe2+ до Fе3+ . Затем добавляют раствор едкой щелочи или аммиака до рН 5—12 и жидкость мед медленно пропускают через колонку (рис.) со стеклянной ватой, предварительно очищенной промыванием соляной кислотой и водой. Железо в виде Fe(OH)3 задерживается ватой.Для растворения Fe(OH)3 через колонку пропускают небольшой объем 0,2 н раствора соляной кислоты. В полученном концентрате определяют железо по реакции с сульфосалициловой кислотой или роданидом аммония.
Аналогичным способом концентрируют и другие элементы.
Выпаривание (упаривание) - самый простой метод концентрирования, заключающийся в испарении растворителя при нагревании раствора.
 (7)
(7)
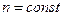 ; V2 < V1; С2 > С1
; V2 < V1; С2 > С1
n – количество вещества растворенного компонента, моль,
V1, V2 - объем раствора в начале и конце процесса упаривания.
Применение метода целесообразно только в тех случаях, когда анализируемая вода содержит небольшие количества растворенных анализируемых веществ, не разлагающихся и не улетучивающихся из пробы при нагревании. Такой метод концентрирования применяют, например, при определении содержания тяжелых металлов в питьевой воде, при анализе дождевой воды. В фарфоровой чашке выпаривают 1 – 10 л подкисленной соляной кислотой исследуемой воды приблизительно до 50 – 100 мл, затем катионы осаждают сероводородом или анализируют другими способами. В некоторых случаях объем исследуемой воды достигает 100 л. Несмотря на простоту, этот метод находит ограниченное применение. Исследуемый раствор вместе с малыми количествами определяемых веществ обычно содержит довольно большие количества других соединений. Поэтому выпаривание до очень малых объемов иногда вообще невозможно из-за выделения растворенных веществ. При выпаривании в растворе повышается концентрация всех растворенных веществ, не достигается отделение анализируемого вещества от сопутствующих веществ часто мешающих дальнейшему его определению. Следует учитывать, что при выпаривании возможно загрязнение пробы за счет некоторого растворения материала лабораторной посуды.
Значительно больший интерес представляет выпаривание в сочетании с предварительным экстрагированием. При экстракции отделяется анализируемое вещество от мешающих анализу примесей. Экстракт можно упарить до очень небольшого объема. Если при экстрагировании достигнуто повышение концентрации анализируемого компонента в n раз, а затем при упаривании концентрация повышается еще в m раз, то в общем в результате проведения двух этапов концентрирования увеличение концентрации происходит в n×m раз.
Соосаждение – один из эффективных методов концентрирования (и разделения) анализируемых микрокомпонент из очень разбавленных растворов. Сущность метода заключается в следующем. В разбавленный раствор анализируемого компонента добавляются вещества, при взаимодействии которых друг с другом образуется осадок – коллектор. Анализируемый компонент ни с одним из добавленных веществ осадка не образует. В процессе осаждения анализируемый микрокомпонент адсорбируется на поверхности частиц образующегося осадка и переходит вместе с ними в осаждаемую твердую фазу – соосаждается. Механизм соосаждения может быть иным (например, могут образовываться смешанные кристаллы и др.). Объем образующегося осадка мал, его растворяют в небольшом количестве соответствующего реагента и анализируют далее каким-либо химическим или физико-химическим методом.
Концентрирование с использованием гидроксида алюминия в качестве коллектора.
В анализируемую пробу воды, загрязненную ионами никеля, добавляют растворимую соль алюминия и гидроксид аммония. Образуется гидроксид алюминия, выпадающий в осадок. Ионы никеля адсорбируются поверхностью гидроксида алюминия, удаляются из раствора с осадком. Процесс протекает при таких значениях рН, при которых гидроксид никеля не образуется
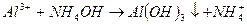 ;
; 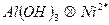 ;
; 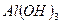 - коллектор.
- коллектор.
Далее осадок отделяется от раствора, растворяется в кислоте, никелиевые соли,
которой хорошо растворимы в воде.
При анализе природных вод возможно соосаждение из 1 л воды до 2×10-6 г Mn2+, Cu2+, Zn2+, Co2+, Ag+, Pb2+ и др.
Концентрирование некоторых ионов путем соосаждения
| Концентрируемый ион (микрокомпонент) | Коллектор | Минимальная концентрация микрокомпонента, при которой возможно его соосаждение | |
| г/л | Моль/л | ||
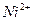
|
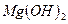
|
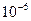
|
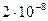
|
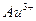
|
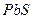
|
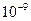
|
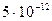
|

|
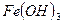
|
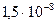
|
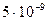
|

|
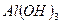
|
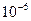
|
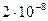
|
Применяемый коллектор, кроме способности увлекать с собой микрокомпонент, должен иметь достаточную плотность (для быстрого оседания), хорошую растворимость в кислотах или других растворителях, не мешать определению микрокомпонента к конечном растворе. Желательно, чтобы макрокомпонент удалялся при прокаливании (например, 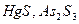 ). Удобными в этом смысле коллекторами являются органические вещества,
). Удобными в этом смысле коллекторами являются органические вещества,
легкоудаляемые,при прокаливании.
 2014-02-09
2014-02-09 703
703
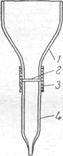 1 — кювета; 2 —бумажный диск; 3 —резиновая трубка; 4 — отводная трубка.
1 — кювета; 2 —бумажный диск; 3 —резиновая трубка; 4 — отводная трубка.
1 — кювета; 2 —бумажный диск; 3 —резиновая трубка; 4 — отводная трубка.
1 — кювета; 2 —бумажный диск; 3 —резиновая трубка; 4 — отводная трубка.
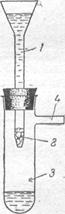 /—колонка; 2 — стеклянная вата; 3 — приемник фильтрата; 4 — трубка для соединения с насосом.
/—колонка; 2 — стеклянная вата; 3 — приемник фильтрата; 4 — трубка для соединения с насосом.







