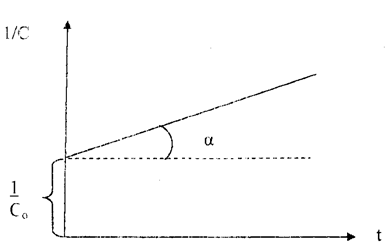
Рис. 40. Зависимость величины обратной концентрации реагента от времени для реакции второго порядка
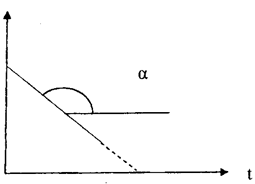
Рис. 39. Зависимость логарифма концентрации реагента от времени протекания для реакции первого порядка
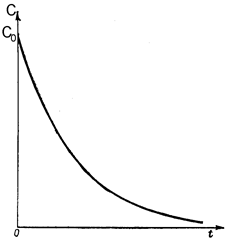
Рис. 38. Изменение концентрации исходного вещества от времени в реакции первого порядка
Рис. 37. Изменение концентрации исходного вещества от времени в реакции нулевого порядка
Математически данная линейная зависимость запишется следующим образом
С = С0 – kt
где k – константа скорости, С0 – начальная молярная концентрация реагента, С – концентрация в момент времени t.
Из неё можно вывести формулу для расчёта константы скорости химической реакции нулевого порядка.
k = 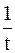 (C0 – C).
(C0 – C).
Константа скорости нулевого порядка измеряется в моль/л? с (моль · л-1· с-1).
Время полупревращения для реакции нулевого порядка пропорционально концентрации исходного вещества
t½ = 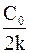
Для реакций первого порядка кинетическая кривая в координатах С,t носит экспоненциальный характер и выглядит следующим образом (рис. 38) Математически данная кривая описывается следующим уравнением
С = С0e-kt
На практике для реакций первого порядка кинетическую кривую чаще всего строят в координатах lnC, t. В этом случае наблюдается линейная зависимость lnС от времени (рис. 39)
ln С = lnС0 – kt
|
Соответственно, величину константы скорости и время полупревращения можно рассчитать по следующим формулам
k = 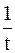 ln
ln  или k = 2,303
или k = 2,303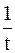 lg
lg 
(при переходе от десятичного логарифма к натуральному).
t½ = 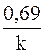
Константа скорости реакции первого порядка имеет размерность t –1, т.е. 1/с и не зависит от единиц измерения концентрации. Она показывает долю, которую составляют молекулы, вступившие в реакцию за единицу времени, от общего числа молекул реагента в системе. Таким образом, в реакциях первого порядка за одинаковые промежутки времени расходуются одинаковы доли взятого количества исходного вещества.
Второй отличительной особенностью реакций первого порядка является то, что t½ для них не зависит от начальной концентрации реагента, а определяется только константой скорости.
Вид уравнения зависимости концентрации от времени для реакций второго порядка рассмотрим только для простейшего случая, когда в элементарном акте участвуют 2 одинаковые молекулы, или молекулы разных веществ, но начальные концентрации их (С0) равны. При этом линейная зависимость наблюдается в координатах 1/С, t (рис. 40). Математическое уравнение этой зависимости запишется следующим образом
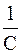 =
= 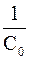 + kt
+ kt
k = 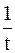 (
(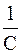 –
– 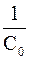 )
)
и измеряется в л?с-1?моль-1, т.е. ее численное значение зависит от того, в каких единицах измеряется концентрация вещества.
Период полупревращения реакций второго порядка обратно пропорционален начальной концентрации реагента
t½= 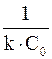
Это связано с тем, что скорость реакций второго порядка в сильной мере зависит от числа столкновений между молекулами реагирующих веществ в единицу времени, которое, в свою очередь, пропорционально числу молекул в единице объема, т.е. концентрации вещества. Таким образом, чем больше концентрация вещества в системе, тем чаще сталкиваются молекулы между собой и тем за меньший промежуток времени половина их успеет прореагировать.
Реакции третьего порядка, как уже было сказано ранее, встречаются крайне редко и не представляют практического интереса. Поэтому в связи с этим мы их не будем рассматривать.
 2014-02-09
2014-02-09 20537
20537
