Продукты реакции могут получиться лишь при условии образования промежуточной конфигурации, называемой активированным комплексом. Эта конфигурация состоит из атомов реагентов, но в ней старые связи еще не целиком разрушились, а новые не успели полностью образоваться.
Покажем схематически механизм данного процесса на примере бимолекулярной реакции, протекающей между двухатомными молекулами по схеме:
АВ + CD → AC + BD
В результате столкновения молекул реагентов связи между атомами в них значительно ослабляются, и происходит образование промежуточного неустойчивого соединения, состоящего из четырех атомов, которое затем распадается с образованием двух новых молекул.
A − B A∙∙∙∙B A B
+ → :: → | + |
C – D C∙∙∙∙D C D
Активированный
комплекс
На образование активированного комплекса необходимо затратить энергию. Величина ее и равняется энергии активации. Конфигурация активированного комплекса и его свойства для большинства химических реакций неизвестны. Несмотря на это, с помощью приближенных квантовомеханических расчетов можно получить качественные результаты, помогающие понять закономерности протекания многих химических явлений.
На рис. 43 представлены энергетические диаграммы эндотермической (а) и экзотермической (б) реакций, поясняющие вышесказанные представления. Здесь по горизонтали отложен ход процесса, а по вертикали – энергия рассматриваемой совокупности веществ; 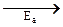 и
и 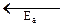 – энергии активации, соответственно, прямой и обратной реакций. Из рис. 43 следует, что тепловой эффект химической реакции определяется не только энергетическим состоянием исходных и конечных веществ, но и разностью энергий активации прямой и обратной реакций.
– энергии активации, соответственно, прямой и обратной реакций. Из рис. 43 следует, что тепловой эффект химической реакции определяется не только энергетическим состоянием исходных и конечных веществ, но и разностью энергий активации прямой и обратной реакций.
Кроме того, независимо от направления процесса при переходе из начального состояния в конечное система должна преодолеть энергетический барьер, равный энергии активации.
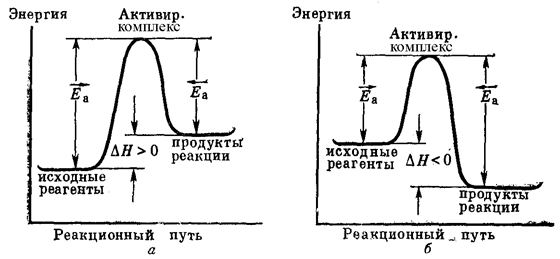
Рис. 43. Изменение энергии реагирующей системы (схема):
а – эндотермическая реакция, б – экзотермическая реакция
Энергию активации химической реакции можно определить экспериментально на основании уравнения Аррениуса для константы скорости, записанного в логарифмической форме:
lg k = -∙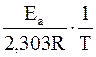 + lg A
+ lg A
Оно представляет собой уравнение прямой в координатах
lg k и 1/Т (рис. 44). Для ее построения необходимо опытным путем определить несколько значений k при разных температурах Т. Тангенс угла наклона прямой равен 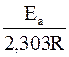 и дает возможность найти величину Еа.
и дает возможность найти величину Еа.
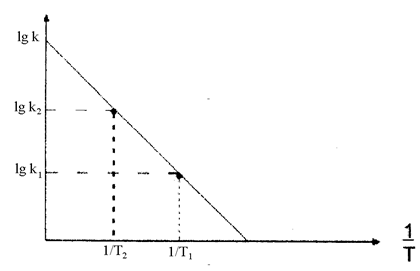
Рис. 44. Графическое определение энергии активации
Величину Еа можно рассчитать и теоретически, зная значения констант скоростей химической реакции k1 и k2 при двух разных температурах Т1 и Т2, с помощью уравнения
lg 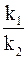 = -
= -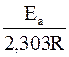 ∙ (
∙ (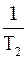 –
– 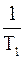 )
)
Оно получено из уравнений Аррениуса для константы скорости химической реакции (в логарифмической форме), записанных для двух разных температур Т1 и Т2, путем их вычитания.
Как уже было показано ранее (рис. 41б), влияние температуры на скорость биохимических реакций носит более сложный характер. Сперва, с повышением температуры, их скорость увеличивается, но до определенного температурного предела (~315 К), при превышении которого происходит резкое уменьшение скорости.
Как правило, многие биохимические процессы протекают с участием ферментов, имеющих белковую природу. Если проследить зависимость активности любого фермента от температуры (рис. 45), то можно заметить аналогичную закономерность, как и со скоростью биохимической реакции. Наибольшей активностью ферменты обладают при температуре 312-315К. Дальнейшее повышение температуры приводит к резкому снижению их активности. Очевидно, это связано с процессом денатурации белковых молекул, протекающим при Т > 315К. При этом происходит нарушение третичной и четвертичной (для сложных белков) структур, вследствие чего ферменты теряют свою активность, и скорость биохимических процессов замедляется. Наиболее оптимальные условия в организме человека для протекания биохимических процессов лежат в достаточно узком температурном интервале 308-311К. При этих условиях большинство ферментов обладают высокой активностью, а вероятность протекания процессов денатурации их молекул мала.
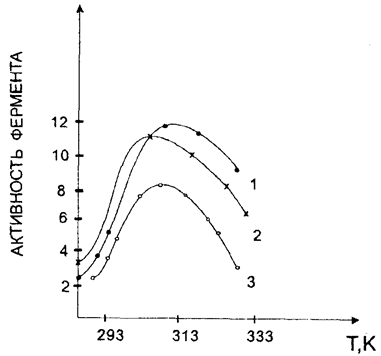
Рис. 45. Активность фермента трипсина в различных организмах от температуры: 1 – собака, 2 – окунь, 3 – треска
В животном мире наблюдаются отступления от этого правила. Так, температура тела некоторых певчих птиц равна 318K. В горячих источниках острова Цейлон при температуре 323K живут и размножаются некоторые виды рыб. Самые жизнестойкие организмы можно найти в мире бактерий. Некоторые из них способны вести нормальную жизнь даже при температуре выше 373K (100оС).
 2014-02-09
2014-02-09 2020
2020
