Классификация спектральных элементов и приборов.
Цели, задачи, классификация методов и областей спектрального анализа.
Спектроскопия – метод исследования спектра поглощения, излучения и рассеяния излучения объектами с целью определения параметров этих объектов.
Для излучательных переходов выполняется соотношение Эйнштейна - Планка:
∆Е = h ν.
Распространены следующие методы спектральных исследований:
1. Эмиссионный.
2. Абсорбционный.
3. Люминесцентный.
4. Комбинационное рассеяние.
5. Спектры отражения.
Комбинационное рассеяние – рассеяние с изменением длины волны излучения.

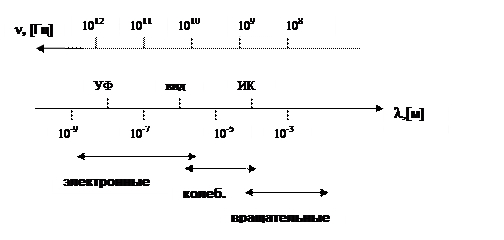
Области спектроскопии:
· Радиочастотное излучение - ЯМР и ЭПР.
· Оптическое излучение - атомные и молекулярные уровни и энергетические зоны регулярных структур.
· Рентгеновское - глубокие энергетические уровни в атомах.
Области спектроскопии показаны на диаграмме рисунка. Там же отражены объекты, создающие излучения соответствующего спектрального диапазона.
|
1. Спектроскоп – прибор для визуального наблюдения спектра.
2. Стилоскоп - спектроскоп с электрической регистрацией; современная версия спектроскопа; отличается большой разрешающей способностью благодаря спектральному элементу - дифракционной решетке. (Разрешающая способность ∆λ/λ порядка 10-4).
3. Спектрограф - разновидность стилоскопа с фотографической регистрацией спектра.
4. Квантометр – приборы с многоканальным анализом с регистрацией сразу нескольких участков спектра.
5. Спектрометр - универсальный прибор для спектроскопических исследований. Например, спектрометры для определения линий и полос в спектрах NSI-600 (фирма NanoSpectrum Instruments).
6. Лазерный спектрометр – приборы активного типа с лазерным источником излучения.
7. Фурье–спектрометр – приборы с чрезвычайно высокой разрешающей способностью, что достигается построением спектрального элемента на основе интерференционных явлений.
8. Спектрофотометры - приборы для количественного анализа, например, спектрофотометры ИКС и СФ, колориметры КФК.

Обобщенная схема спектрофотометра.
Классификация спектральных элементов

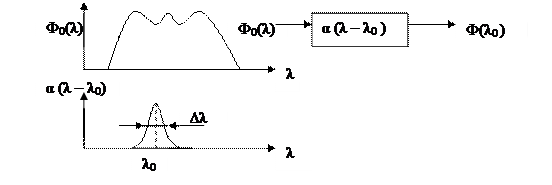
Реализация аппаратной функции спектрального элемента:
φ(λ) - спектр излучения; α(λ – λ0) - функция пропускания; λ0 - рабочая длина волны; ∆λ - полуширина спектра пропускания.
Спектр, формируемый спектральным элементом:
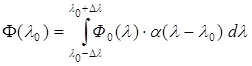
Аппаратная функция идеального спектрального элемента – δ-функция Дирака: α(λ-λ0)=δ(λ0).
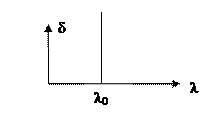 В этом случае Ф(λ0)=Ф0(λ0)
В этом случае Ф(λ0)=Ф0(λ0) 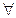 λ
λ
22. Развитие атомно–эмиссионной спектроскопии
 История спектральных исследований начинается с XIX века. Ранние исследования проводились на приборах с визуальным наблюдением или с фотографической регистрацией спектров. В 1814 году Фраунгофер изготовил прибор, который содержал призму со зрительной трубой, через которую можно наблюдать свет, пропущенный через щель.
История спектральных исследований начинается с XIX века. Ранние исследования проводились на приборах с визуальным наблюдением или с фотографической регистрацией спектров. В 1814 году Фраунгофер изготовил прибор, который содержал призму со зрительной трубой, через которую можно наблюдать свет, пропущенный через щель.
Фраунгофер наблюдал солнечный спектр и обнаружил в нем дискретные линии, названные впоследствии линиями Фраунгофера.
Вскоре после этого Кирхгоф сформулировал два так называемых основных закона спектроскопии, которые теперь называют законами Кирхгофа.
1. Каждое вещество обладает своим специфическим спектром излучения.
2. Вещество поглощает энергию на тех же частотах, на которых оно способно эту энергию излучать.
Атомно – эмиссионная спектроскопия изучает спектры излучения атомов.
Формула Бальмера: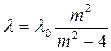 , где m = 3,4…11. λ0 = 364,613 нм.
, где m = 3,4…11. λ0 = 364,613 нм.
Формула Ридберга: 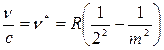 , где m = 3,4…11., R = 10973,731*м-1 – постоянная Ридберга.
, где m = 3,4…11., R = 10973,731*м-1 – постоянная Ридберга.
Величина  , получившая название волнового числа, широко используется в спектроскопии.
, получившая название волнового числа, широко используется в спектроскопии.
Далее аналогичные закономерности были обнаружены в невидимых областях спектра:
Серия Пашена: 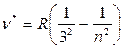 .
.
Серия Лаймана: 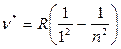 .
.
Для стационарных уровней энергии: 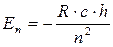
Поэтому 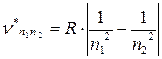 .
.
Учитывая экспериментально определенное значение энергии связи, энергии квантовых переходов могут быть записаны формулой:
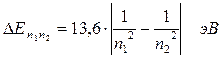 .
.
Откуда следует: 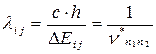
Общая теория квантового состояния атомной системы описывается уравнением Шредингера, которое в общей форме включает следующие операторы и функции:
Ĥψ = Eψ,
где Ĥ – оператор Гамильтона,
ψ - волновая функция электрона,
Е – его энергия.
Решение стационарного уравнения Шредингера позволило определить энергетические состояния электронов в атомах. Энергетические уровни характеризуются четырьмя квантовыми числами:
¨ l – орбитальное квантовое число, характеризующее форму электронного облака;
¨ m – магнитное квантовое число, характеризующее магнитный момент орбиталей;
¨ s – спин, характеризующий собственный магнитный момент электрона.
Наличие спина приводит к так называемому тонкому расщеплению спектральных линий, пара линий получила название дублета, может быть выявлена на спектральных приборах высокого разрешения.
23. Естественная ширина спектральных линий
В 1916 году Эйнштейн ввел параметр вероятности самопроизвольного перехода атома из состояния n в состояние m: Anm. Величина Anm названа коэффициентом Эйнштейна для спонтанного излучения. Она показывает связь между количеством атомов, совершивших переход ∆N и числом атомов, находящихся на исходном энергетическом уровне Nn: -∆N=Anm∙Nn∙∆t. Откуда:
dN / Nn = - Anm ∙ dt,
Решение этого уравнения:
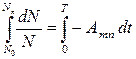 ,
,
Дает формулу для количества заполненных орбиталей Nn:
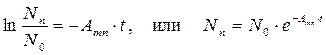
Время жизни носителя заряда на дискретном энергетическом уровне:
τ = (Anm) – 1
Исходя из конечного значения времени жизни носителей, удается объяснить факт размытия реальных спектров излучения относительно центральных длин волн линий λi. показанный на рисунке
 Уширение спектральной линии обусловлено постулатами квантовой физики, а именно принципом неопределенности Гейзенберга, и называется естественной шириной спектральных линий. Естественная ширина спектральной линии вычисляется из соотношения неопределённости Гейзенберга:
Уширение спектральной линии обусловлено постулатами квантовой физики, а именно принципом неопределенности Гейзенберга, и называется естественной шириной спектральных линий. Естественная ширина спектральной линии вычисляется из соотношения неопределённости Гейзенберга:
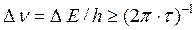
Существуют другие причины размытия спектра излучения:
ü доплеровское уширение ввиду теплового движения излучающих частиц;
ü взаимодействие атомов.
Обобщенная схема прибора атомно–эмиссионной спектроскопии приводится на рисунке.

Чтобы наблюдать атомные спектры требуется а томизатор –устройство, повышающее внутреннюю энергию вещества и переводящего его в атомный пар. Основные способы атомизации, применяемые в эмиссионной спектроскопии.
ü Пламя (атомизируются растворы при температурах 1500 – 3000 К).
ü Электрическая дуга (атомизируются твердые тела при температурах 3000–7000К).
ü Электрическая искра (исследуются твердые тела при температурах порядка 104 К).
ü Индуктивно связанная плазма – ионизированный газ пламени удерживается магнитным полем (атомизируются растворы при температурах порядка 10 4 К).
При выборе параметров атомизаторов следует учитывать статистические законы закон распределения носителей по энергетическим уровням. Закон Больцмана:
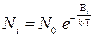 ,
,
где Еi – энергия орбиты;
N0 – параметр распределения.
Демонстрация закона распределения электронов по уровням энергии на рисунке.
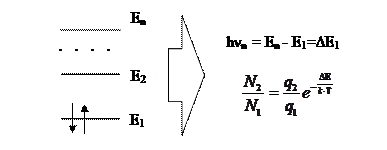
где q1 и q2 – статистические веса энергетических состояний
Количество электронов, которые могут совершать переходы с потерей энергии, и, соответственно, излучать кванты электромагнитной энергии
Nф ≈ N2 = N1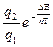
Анализ формул показывает:
ü Эмиссия возрастает при увеличении температуры. Поэтому для проведения эмиссионного анализа требуется высокая температура.Средняя энергия теплового движения атомов идеального газа должна превышать энергию квантов эмиссионного излучения.
ü Интенсивность эмиссионного излучения экспоненциально убывает при увеличении энергии исходного возбужденного состояния Е2.
ü Атомно-эмиссионная спектроскопия позволяет определить статистические веса q1 и q2 волновых функций электронов в атомах. Из (38.2) следует соотношение
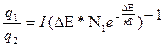
Спектральные помехи в атомно – эмиссионном исследовании вызваны наложением атомных линий полезного излучения и фона. Для выделения полезного сигнала требуются спектральные элементы высокого разрешения: дифракционные решетки или интерференционные элементы, например, Фурье – спектроанализаторы.
 2014-02-24
2014-02-24 4139
4139
