Ответы
Задачи
|
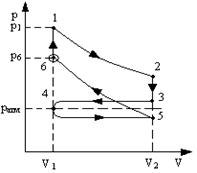
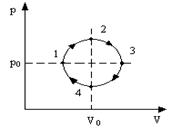 2.1. Циклический процесс представлен в координатах (p,V) в форме окружности с центром в точке (p0,V0), максимальный объем и давление равны соответственно Vmax и pmax. (рис.8) Изобразить на графике работу расширения, сжатия. Найти:
2.1. Циклический процесс представлен в координатах (p,V) в форме окружности с центром в точке (p0,V0), максимальный объем и давление равны соответственно Vmax и pmax. (рис.8) Изобразить на графике работу расширения, сжатия. Найти:
а) работу расширения;
б) работу сжатия;
|
 2.2. У тепловой машины, работающей по циклу Карно, температура нагревателя в α раз больше температуры холодильника. За один цикл машина производит работу А. Какая работа за цикл затрачивается на изотермическое сжатие? Решить эту же задачу, считая α=1,6; А=12 кДж.
2.2. У тепловой машины, работающей по циклу Карно, температура нагревателя в α раз больше температуры холодильника. За один цикл машина производит работу А. Какая работа за цикл затрачивается на изотермическое сжатие? Решить эту же задачу, считая α=1,6; А=12 кДж.
2.3. В каком случае КПД цикла Карно повысится больше: при увеличении температуры нагревателя на ∆Т или при уменьшении температуры холодильника на такую же величину?
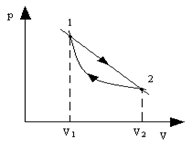
2.4. Найти КПД цикла, проводимого с идеальным газом и состоящего из двух изотерм с температурами Т1 и Т2 и двух изохор с объемами V1 и V2.(Т1>T2, V1>V2)
|
|
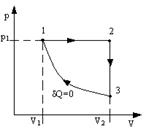
2.6. Идеальный газ совершает цикл, состоящий из чередующихся изотерм и адиабат (рис.10). Температуры, при которых происходят изотермические процессы, равны Т1, Т2, Т3. Найти КПД такого цикла, если при каждом изотермическом расширении объем газа увеличивается в одно и тоже число раз.
2.7. Определить КПД цикла, изображенного на рис.11. Переход 2-1 адиабата. Известны V1, V2, T1 и Cv=const.
|
|
случае цикл идеальный, считаем, что 5 совпадает с 3, путь 3-4 совпадает с 4-5 и работа на 4-5 не совершается.
2.9. Тепловую машину, работавшую по циклу Карно с КПД η=10%, используют при тех же тепловых резервуарах как холодильную машину. Найти ее КИЭ.
2.10. В помещении необходимо поддерживать температуру 25˚С, когда температура наружного воздуха 35˚С. Обеспечит ли требуемую температуру кондиционер, который при работе по циклу Карно в качестве тепловой машины имеет η=5%; на основе теоремы Карно оценить КИЭ данной машины.
2.11. Сделайте оценку (сверху) КИЭ бытового холодильника, если температура морозильной камеры - 20˚С.
2.1. 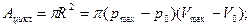
2.2. 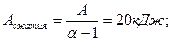
2.3. во втором;
 |
2.4.
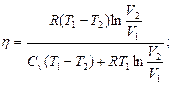
2.5. 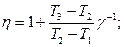
2.6. 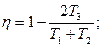
2.7. 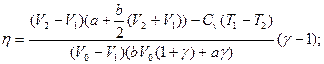
2.8. 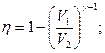
2.9. 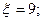
2.10. да;
2.11. 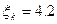
Второе начало термодинамики имеет особый статус не только фундаментального закона физики, но и универсального принципа естествознания в целом.
Второе начало дает информацию о направлении процессов, которые могут происходить в действительности. Оно, совместно с первым началом, позволяет установить множество точных количественных соотношений между различными макроскопическими параметрами тел в состоянии термодинамического равновесия. Это оказывается возможным благодаря определению такой величины как энтропия через теплоту. Энтропия (греч. – поворот, превращение) служит мерой преобразования или эволюции системы.
Существует несколько десятков различных формулировок второго начала. В большинстве из них термин «энтропия» не используется (см. формулировки Кельвина, Клаузиуса и Оствальда).
Такие процессы невозможны. Они запрещены вторым началом.
|
|
|
Часть первая. Каждая термодинамическая система обладает функцией состояния, называемой энтропией. Энтропия вычисляется следующим образом. Система переводится из произвольно выбранного начального состояния в соответствующее конечное состояние через последовательность состояний равновесия. Вычисляются все подводимые при этом к системе порции тепла 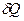 , делятся каждая на соответствующую ей абсолютную температуру Т и все полученные таким образом значения суммируются.
, делятся каждая на соответствующую ей абсолютную температуру Т и все полученные таким образом значения суммируются.
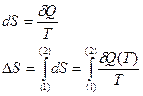 (13)
(13)
Часть вторая. При реальных (не идеальных) процессах энтропия замкнутой системы возрастает.
Содержание второй части формулировки А.Зоммерфельда в большинстве учебников рассматривается как самодостаточная формулировка второго начала, или как закон возрастания
энтропии:
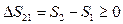 (14)
(14)
Энтропия не убывает только в процессах изолированной системы, в неизолированной системе энтропия может и возрастать,
и убывать, и оставаться неизменной. Рост энтропии в изолированной системе означает приближение системы к состоянию термодинамического равновесия; в этом состоянии S – максимальна, а dS=0. 
Расчет изменения энтропии в различных процессах изучаемых систем зачастую является актуальной внутренней подзадачей разнообразных задач термодинамики, химии биологии, лингвистики. В частности, изменение энтропии служит мерой изменения качества энергии. Важнейшим условием для тепловых машин, работающих по произвольному циклу, является условие их максимально допустимой эффективности:
 (за цикл) (15)
(за цикл) (15)
Большинство процессов, происходящих в природе, необратимы, например: диффузия, расширение, растворение. Для таких процессов вычисление энтропии основывается на том, что S – функция состояния. Если система перешла из одного состояния в другое необратимым образом, то можно мысленно заменить необратимый процесс обратимым, причем начальное и конечное состояния этого процесса должны быть равновесны, рассчитанное в этом случае изменение энтропии будет равно изменению энтропии при реальном необратимом процессе.
 2014-02-24
2014-02-24 1128
1128