Зависимость теплоты реакции
Суммарные теплоемкости веществ при постоянном объеме соответственно до и после реакции равны
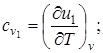
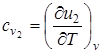 , (6.7)
, (6.7)
где u1 и u2 –внутренняя энергия системы соответственно в начальном и конечном состояниях; 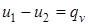 , следовательно
, следовательно
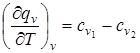 ,
,
где 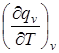 называется температурным коэффициентом теплоты изохорной реакции или температурным коэффициентом теплового эффекта реакции.
называется температурным коэффициентом теплоты изохорной реакции или температурным коэффициентом теплового эффекта реакции.
Суммарные теплоемкости начальных и полученных веществ 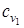 и
и 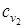 определяются при расчетах, как теплоемкости смеси газов.
определяются при расчетах, как теплоемкости смеси газов.
Соответственно температурный коэффициент теплоты изобарной реакции равен разности суммарных теплоемкостей ср исходных и полученных веществ:
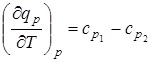 . (6.8)
. (6.8)
Следовательно в общем случае полученные соотношения имеют вид 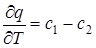 :
:
если с1 – с2 >0, то теплота реакции при увеличении температуры увеличивается;
если с1 – с2 <0, то теплота реакции при увеличении температуры уменьшается;
если с1 – с2 =0, то теплота реакции не зависит от температуры.
Взаимозависимость температурного коэффициента теплоты реакции и разности соответствующих суммарных теплоемкостей исходных и конечных компонентов реакции называется законом Кирхгофа.
Уравнения для 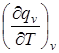 и
и 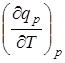 позволяют вывести расчетное уравнение q=f(T), которое применяется при вычислении теоретическим путем теплоты реакции при заданной температуре.
позволяют вывести расчетное уравнение q=f(T), которое применяется при вычислении теоретическим путем теплоты реакции при заданной температуре.
 2014-02-24
2014-02-24 496
496








