Скорость прямой реакции w1 непрерывно уменьшается, а скорость обратной реакции w2 непрерывно увеличивается, и в тот момент, когда скорость обратной реакции становится равной скорости прямой реакции, наступает химическое равновесие: w1 =w2.
Рассмотрим реакцию
 .
.
Если концентрация веществ при химическом равновесии обозначить сА, сВ, сС и сD, причем 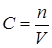 (для идеальной газовой системы), то
(для идеальной газовой системы), то
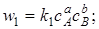
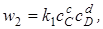
где k1 и k2 –константы скорости прямой и обратной реакций.
При химическом равновесии w1 =w2, т.е.
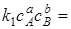
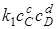 ;
;
и
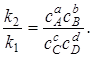
Отношение 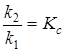 -константа равновесия химической реакции:
-константа равновесия химической реакции:
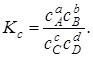 (6.11)
(6.11)
Выражение константы равновесия может быть представлено через парциальные давления (для идеальной газовой системы):
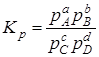 , (6.12)
, (6.12)
где рА, рВ, рС и рD –парциальные давления отдельных газов в смеси при химическом равновесии.
Константы Кс и Кр связаны зависимостью
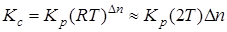 , (6.13)
, (6.13)
где 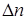 -изменение числа молей в реакции.
-изменение числа молей в реакции.
Для реакции 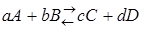
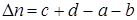 .
.
Например, для реакции
СО + Н2О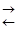 Н2 + СО2
Н2 + СО2
при 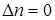 Кс = Кр; при
Кс = Кр; при 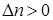 Кс > Кр; при
Кс > Кр; при 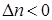 Кс < Кр .
Кс < Кр .
Зависимость констант равновесия от температуры:
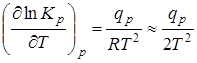 ,
,
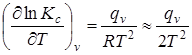 (6.14)
(6.14)
Приведенные уравнения показывают, что знак изменения константы равновесия при увеличении температуры зависит от знака теплоты реакции (Закон Вант-Гоффа).
Из закона Вант-Гоффа следует, что в экзотермических реакциях тепловой эффект положителен (q > 0) и, следовательно, 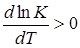 . В таких реакциях при увеличении температуры увеличивается и константа равновесия К. Увеличение последней означает, что при равновесии возрастает концентрация исходных веществ и убывает концентрация веществ, получаемых в реакции, т.е. для осуществления экзотермических реакций благоприятны низкие температуры.
. В таких реакциях при увеличении температуры увеличивается и константа равновесия К. Увеличение последней означает, что при равновесии возрастает концентрация исходных веществ и убывает концентрация веществ, получаемых в реакции, т.е. для осуществления экзотермических реакций благоприятны низкие температуры.
В эндотермических реакциях тепловой эффект отрицателен (q < 0) и в них при увеличении температуры константа равновесия уменьшается 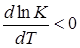 . Это означает, что при равновесии уменьшается концентрация начальных веществ и увеличивается концентрация полученных веществ, т.е. для эндотермических реакций благоприятны высокие температуры.
. Это означает, что при равновесии уменьшается концентрация начальных веществ и увеличивается концентрация полученных веществ, т.е. для эндотермических реакций благоприятны высокие температуры.
Зависимость констант равновесия от температуры может быть выражена следующим образом:
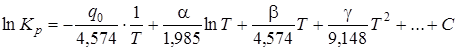 , (6.15)
, (6.15)
где q0 –тепловой эффект при абсолютном нуле температуры (можно определить исходя из значений q298 при стандартных условиях), а С –константа интегрирования, определяемая в соответствии с законом Нернста.
В конденсированных системах С = 0 (закон Нернста).
Таблица 6.1
Химические константы i и условные
химические константы j
| Вещество | Химическая константа i | Условная химическая константа j |
| Н2 | -368 | +1,6 |
| N2 | -3,11 | +2,6 |
| Вещество | Химическая константа i | Условная химическая константа j |
| O2 | +0,65 | +2,8 |
| CO | -0,07 | +3,5 |
| CO2 | +0,8 | +3,2 |
| H2O | +1,95 | +3,6 |
| CH4 | -1,96 | +2,5 |
| NO | +0,52 | +3,5 |
| N2 | -3,11 | +2,6 |
В газовых системах
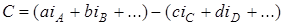 ,
,
где i –химические константы соответствующих веществ (табл. 6.1).
Иногда принимают приближенное уравнение
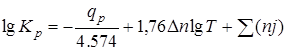 ,
,
где qp –тепловой эффект при комнатной температуре и
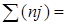
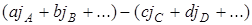 ,
,
где j –условные химические константы соответствующих веществ.
Ориентировочно можно принимать j = 1,5 для одноатомных газов и водорода и j = 3,0 для двух- и многоатомных газов.
От давления константы равновесия зависят незначительно, и при не очень высоких давлениях зависимостью Кс и Кр от давления пренебрегают.
 2014-02-24
2014-02-24 761
761








