Химическое сродство.
Химической реакции
Уравнение максимальной работы
Вопросы для самопроверки
1. Сколько параметров могут оставаться постоянными при протекании в системе химической реакции?
2. Запишите первый закон термодинамики для химически активной системы.
3. Что такое тепловой эффект химической реакции?
4. Как связаны тепловые эффекты изохорно –изотермических Qv и изобарно –изотермических Qp реакций?
5. Сформулируйте закон Гесса и его основные следствия.
6. Каким законом определяется зависимость теплового эффекта химической реакции от температуры, при которой она протекает?
7. Что такое скорость химической реакции?
8. Сформулируйте закон действующих масс.
9. Что такое химическая обратимость реакции?
10. Дайте определение констант равновесия Кс и Кр. Какая связь существует между этими величинами?
11. Каким способом, зная константу равновесия, вычислить равновесный состав?
12. Что такое степень диссоциации и как она связана с константой равновесия?
13. Как зависит от давления степень диссоциации у реакций, протекающих с изменением и без изменения количества вещества?
Химический потенциал. Уравнение максимальной работы химической реакции (уравнение Гиббса –Гельмгольца). Химическое сродство. Константа равновесия и максимальная работа реакции. Зависимость константы равновесия от давления и температуры. Тепловая температура Нернста. Стандартные значения термодинамических функций веществ.
По теме не предусмотрены практические занятия, лабораторные и контрольные работы.
После изучения теоретического материалы следует ответить на вопросы для самопроверки по этой теме. Ответы можно найти в учебниках [1,3].
Причиной реакции является химическое сродство реагирующих веществ, т.е. сила их стремления к соединению.
За меру химического сродства принимается максимальная работа реакции, величина которой для реакции 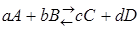 может быть определена по следующим уравнениям:
может быть определена по следующим уравнениям:
При v, Т = const
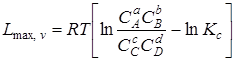
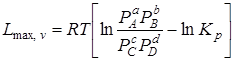 . (6.16)
. (6.16)
При р, Т = const
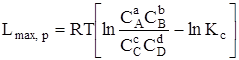
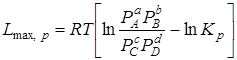 , (6.17)
, (6.17)
где С –начальные концентрации; Р –начальные парциальные давления соответствующих газов.
Эти уравнения позволяют решить вопросы о возможности осуществления реакции при заданных условиях и о направлении реакции. Для этого следует сравнить значение  , вычисленное по заданным начальным концентрациям веществ, со значением константы равновесия Кс, взятым из таблиц для рассматриваемой реакции при заданных условиях.
, вычисленное по заданным начальным концентрациям веществ, со значением константы равновесия Кс, взятым из таблиц для рассматриваемой реакции при заданных условиях.
Если  > Kc, т.е. L max > 0, то при заданных условиях возможна прямая реакция превращения веществ А и В, в вещества С и D.
> Kc, т.е. L max > 0, то при заданных условиях возможна прямая реакция превращения веществ А и В, в вещества С и D.
Если  < Kc, т.е. L max < 0, то при заданных условиях невозможна прямая реакция соединения веществ А и В, а возможна только обратная реакция –распада веществ С и D на вещества А и В. Если L max = 0, то это означает, что при заданных условиях невозможны ни прямая, ни обратная реакции, так как при этих условиях система находится в химическом равновесии.
< Kc, т.е. L max < 0, то при заданных условиях невозможна прямая реакция соединения веществ А и В, а возможна только обратная реакция –распада веществ С и D на вещества А и В. Если L max = 0, то это означает, что при заданных условиях невозможны ни прямая, ни обратная реакции, так как при этих условиях система находится в химическом равновесии.
Ввиду того, что максимальная работа одной и той же реакции при одной и той же температуре есть величина переменная, зависящая от начальных концентраций веществ, для оценки химического сродства максимальные работы различных реакций берутся при начальных концентрациях всех веществ, равных единице. При этом
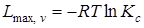
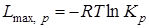 ,
,
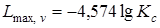 .
.
 (6.18)
(6.18)
Последнее уравнение может быть применено для вычисления уменьшения свободной энергии и термодинамического потенциала, так как
 ;
; 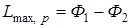 ;
;
при этом
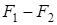
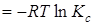 =
=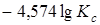
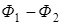
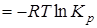 =
=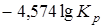 .
.
Закон Нернста (тепловая теорема). Согласно закону Нернста вблизи абсолютного нуля в реакциях, протекающих в конденсированных системах, равны максимальные работы и тепловые эффекты:
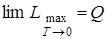 ,
,
а также
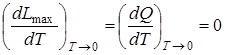 . (6.19)
. (6.19)
По закону Нернста постоянная интегрирования в уравнениях константы равновесия и максимальной работы для конденсированных систем равна нулю.
Следствие тепловой теоремы:
1. При абсолютном нуле теплоемкость сi конденсированных тел равна нулю:
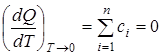 .
.
Опытные данные позволяют предположить, что при абсолютном нуле не только алгебраическая сумма теплоемкостей, но и теплоемкость каждого тела в отдельности равна нулю.
2. При абсолютном нуле энтропия конденсированных тел равна нулю:
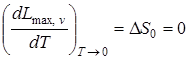 .
.
 2014-02-24
2014-02-24 1557
1557








