Химическое равновесие
Теория химического равновесия рассматривается на основе второго закона термодинамики и закона действующих масс, открытого в начале 60 –х годов прошлого столетия. Одним из первых идею закона действующих масс предложил Н.Н.Бекетов (1827 – 1911 гг.).
Под объемно –мольной концентрацией подразумевается число молей вещества в единице объема (1 м3), т.е. 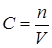 , где С –концентрация вещества; n –число молей и V –объем в м3.
, где С –концентрация вещества; n –число молей и V –объем в м3.
Скорость химической реакции. Под скоростью химической реакции подразумевается количество вещества в молях, прореагировавшее в единице объема за единицу времени.
При химическом равновесии обе реакции –прямая и обратная осуществляются с одинаковыми скоростями.
Закон действующих масс. Скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. Для реакции 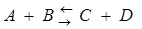 скорость прямой и обратной реакций w1 и w2 равны
скорость прямой и обратной реакций w1 и w2 равны
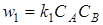 и
и 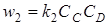 , (6.10)
, (6.10)
где СА, СВ, СС и СD –концентрации веществ A, B, C, D; k1 и k2 –коэффициенты пропорциональности –так называемые константы прямой и обратной реакций.
 2014-02-24
2014-02-24 442
442








