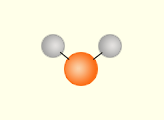Раздел 1 Общая и неорганическая химия
Учебное пособие
КОЛЛЕДЖ СВЯЗИ
Федеральное агентство связи
Государственное образовательное бюджетное учреждение высшего профессионального образования
«Поволжский государственный университет телекоммуникаций и информатики»
Утверждаю
Зам. директора по УВР
____________А.В. Логвинов
«» ______________2013 г.
по дисциплине «Химия»
по программе, утверждённой зам. директора по УВР Логвиновым А.В.
«_____» ______________2013 года
для специальностей:
080114 «Экономика и бухгалтерский учёт в связи»
210709 «Многоканальные телекоммуникационные системы»
210723 «Сети связи и системы коммутации»
230115 «Программирование в компьютерных системах»
230401 «Информационные системы в связи»
рассчитано на 40 часов
РАССМОТРЕНО
На заседании цикловой комиссии №1 « Общих гуманитарных дисциплин »
Председатель комиссии М.М. Никифоров
Протокол № ____ от «___» ___________ 2013 г.
САМАРА
2013 г.
Шукова, М.Г. Курс лекций по химии для студентов СПО [Текст] – Самара: КС ПГУТИ, 2013. – 96 с.
Учебное пособие предназначено для студентов СПО всех форм обучения специальностей:
080114 «Экономика и бухгалтерский учёт в связи»
210709 «Многоканальные телекоммуникационные системы»
210723 «Сети связи и системы коммутации»
230115 «Программирование в компьютерных системах»
230401 «Информационные системы в связи»
В учебном пособии лекций раскрыты основные темы дисциплины «Химия».
Содержание
Раздел 1 Общая и неорганическая химия. 4
Тема 1.1 Основные понятия и законы химии. 4
Тема 1.2 Периодический закон и периодическая система химических элементов Д.И. Менделеева и строение атома. 11
Тема 1.3 Строение вещества и химическая связь. 20
Тема 1.4 Вода. Растворы. Электролитическая диссоциация. 25
Тема 1.5 Классификация неорганических соединений и их свойства. 33
Тема 1.6 Химические реакции. 41
Тема 1.7 Металлы и неметаллы.. 51
Раздел 2 Органическая химия. 68
Тема 2.1 Основные понятия органической химии и теория строения органических соединений. 68
Тема 2.2 Углеводороды.. 78
Тема 2.3 Кислородсодержащие органические соединения. 80
Тема 2.4 Азотсодержащие органические соединения. Полимеры.. 83
Список рекомендуемой литературы.. 88
Приложение А.. 89
Приложение Б. 90
Приложение В.. 91
Приложение Г. 92
Приложение Д.. 93
Приложение Е. 94
Химия изучает свойства веществ и закономерности процессов, сопровождающихся изменениями их структуры и состава.
Объектами изучения в химии служат: атомы, ионы, молекулы, радикалы, растворы, коллоидные и дисперсные частицы, кристаллические, стеклообразные и полимерные системы, координационные и кластерные соединения.
Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все свойства, определенные зарядом ядра и электронной оболочкой. Составная часть вещества, содержащая одинаковые атомы, называется химическим элементом.
Атомный номер Z равен числу протонов в атомном ядре. В электронной оболочке электронейтрального атома содержится Zэлектронов.
Массовое число A равно числу протонов Z и числу нейтронов N в атомном ядре; A = Z + N.
Нуклиды – атомы с определенным числом протонов и нейтронов.
Таблица 1- Классификация нуклидов
| Нуклид | Изотоп | Z | N | A | Вид нуклида |
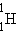
| протий | изотопы | |||
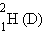
| дейтерий | ||||
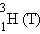
| тритий | ||||
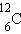
| углерод-12 | изотопы | |||
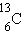
| углерод-13 | ||||
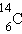
| углерод-14 |
Изотопы – атомы с одинаковым Z, но разными N.
Изобары – атомы с одинаковым A, но разными Z.
Изотоны – атомы с одинаковым N, но разными A.
Элемент обозначается установленным одно- или двухбуквенным символом. Левые индексы указывают массовое число A (верхний) и число протонов Z (нижний).
Атомная масса – масса атома в атомных единицах массы (а. е. м.). За единицу а. е. м. принята 1/12 массы изотопа углерод-12.
Относительная атомная масса (безразмерная величина) 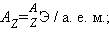 она численно равна атомной массе элемента.
она численно равна атомной массе элемента.
Относительная атомная масса элемента с учетом его изотопного состава равна 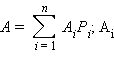 – относительная атомная масса изотопа,
– относительная атомная масса изотопа, 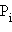 – доля изотопов в элементе.
– доля изотопов в элементе.
Молекула – наименьшая частица вещества, определяющая его свойства, способная к самостоятельному существованию. Состоит из одинаковых или разных атомов.
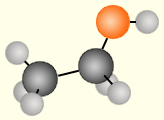
Соединения, образованные одинаковыми атомами, называют простыми (He, O2, O3, H2, S8), а образованные разными атомами – сложными (H2O, H2O2, NH3, CCl4, C2H5OH).
|
|
Рисунок 1 – Молекулы сложных веществ
Атомы в молекуле удерживаются химическими связями, возникающими в результате обобществления или перераспределения внешних (валентных) электронов. Каждая обобществленная пара электронов изображается чертой, соединяющей связываемые атомы.
Ионы – заряженные одно- или многоатомные частицы, образующиеся в результате отрыва (присоединения) электрона (электронов) от атома или молекулы с образованием энергетически устойчивых электронных оболочек:
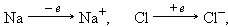
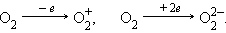
Образование сложных ионов возможно путем присоединения к нейтральным молекулам других ионов:
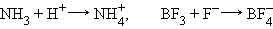
Образование поваренной соли NaCl из простых веществ сопровождается полным переходом электрона от натрия к хлору с образованием ионов Na+ и Cl–В кристаллическом NaCl нет молекул. Кристалл поваренной соли состоит из катионов Na+ и анионов Cl–, которые образуют трехмерную решетку. Каждый из ионов занимает центр октаэдра, вершины которого заняты ионами противоположного знака.
Способность атома присоединять или замещать определенное число других атомов называют валентностью. Мерой валентности считают число атомов водорода или кислорода, присоединенных к элементу (ЭHn, ЭOm), при условии, что водород одно-, а кислород двухвалентен.
Степень окисления – условный заряд атома элемента, полученный в предположении, что соединение состоит из ионов. Она может быть положительной, отрицательной, нулевой, дробной и обозначается арабской цифрой со знаком «+» или «–» в виде верхнего правого индекса символа элемента: Cl–, Cl7+, O2–, H+, Mg2+, N3–, N5+, Cr6+.
Для определения степени окисления элемента в соединении (ионе) пользуются следующими правилами:
1 В простых веществах (H2, S8, P4) окисления элемента равна нулю.
2 Постоянную окисления элемента имеют щелочные (Э+) и щелочно-земельные (Э2+) элементы, а также фтор F–.
3 Водород в большинстве соединений имеет окисления элемента H+ (H2O, CH4, HCl), в гидридах – H– (NaH, CaH2); окисления элемента кислорода, как правило, равна –2 (O2–), в пероксидах (–O–O–) –1 (O–).
4 В бинарных соединениях неметаллов отрицательная с. о. приписывается элементу, расположенному справа 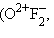
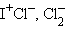 ).
).
Алгебраическая сумма окисления элемента молекулы равна нулю, иона – его заряду.
Радикалы – частицы, образующиеся при разрыве химической связи, и (или) содержащие нескомпенсированную валентность: 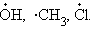
Особую группу составляют свободные радикалы (СР) – химические частицы, содержащие нескомпенсированную валентность (электрон), они могут быть нейтральными или заряженными (ион-радикалы):
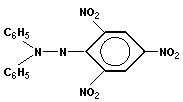 нейтральный СР (ДФПГ)
нейтральный СР (ДФПГ)
дифенилпикрилгидролил (ДФПГ)
2ArSCH3 → ArSCH3+∙ +ArSCH3–
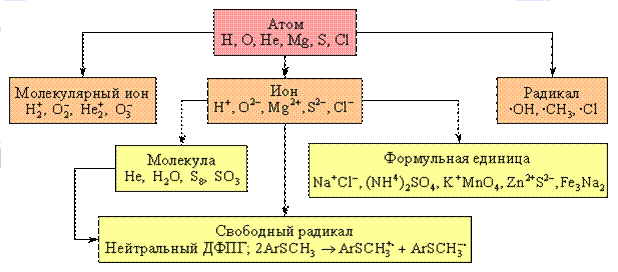
Классификация атомно-молекулярных частиц и образований приведена на рис. 2.
|
Рисунок 2 - Классификация атомно-молекулярных частиц и образований
Электроотрицательность (ЭО) – способность атома оттягивать на себя электрон в химическом соединении.
Разность электроотрицательностей элементов в соединении пропорциональна ионности связи взаимодействующих атомов; нулевая разность соответствует образованию ковалентной связи.
Таблица 2 - Значения электроотрицательности важнейших элементов
| Н 2,1 | ||||||
| Li 0,98 | Be 1,5 | В 2,0 | С 2,5 | N 3,07 | 3,5 | F 4,0 |
| Na 0,93 | Mg 1,2 | Al 1,6 | Si 1,9 | P 2,2 | S 2,6 | Cl 3,0 |
| К 0,91 | Ca 1,04 | Ga 1,8 | Ge 2,0 | As 2,1 | Se 2,5 | Br 2,8 |
| Rb 0,89 | Sr 0,99 | In 1,5 | Sn 1,7 | Sb 1,8 | Те 2,1 | I 2,6 |
В периодах электроотрицательность растет, а в группах уменьшается с ростом Z, то есть растет от Cs к F по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сходство элементов.
Эмпирическая формула составляется из атомных символов элементов, записываемых в определенном порядке друг за другом.
Молекулярная формула соответствует истинному молекулярному составу соединения: S2Cl2, C6H6, а не SCl, CH. При изменении состава молекулы в зависимости от температуры берут самую простую формулу: S, P, NO2 вместо S8, P4, N2O4.
Моль – количество вещества, содержащее столько же частиц или структурных единиц (атомов, ионов, молекул, радикалов, электронов, эквивалентов и др.), что и в 12 а. е. м. изотопа углерода-12.
В структурной формуле указываются последовательность соединения атомов в молекуле (плоская структурная формула) и пространственное расположение атомов в соединении (проекционная структурная формула).
Катион в формулах солей всегда ставится на первое место: MgCl2, KMnO4, (NH4)2CO3.
Если соль содержит более одного катиона или более одного аниона, то в формуле они записываются в алфавитном порядке их символов: KCr(SO4)2, PtBr2Cl2.
Кислоты рассматриваются как соли протона H+: HCl, H2SO4, H3PO4.
Основания – соединения, у которых анионом служит гидроксид-ион OH–: KOH, Al(OH)3.
Основные законы стехиометрии, включающие законы количественных соотношений между реагирующими веществами с помощью уравнений химических реакций, вывод формул химических соединений, составляют раздел химии, называемый стехиометрией. Стехиометрия включает в себя законы Авогадро, постоянства состава, кратных отношений, Гей-Люссака, эквивалентов и сохранения массы.
В основу составления химических уравнений положен метод материального баланса, основанный на законе сохранения массы (М. В. Ломоносов, 1748, А. Лавуазье, 1789).
Закон сохранения массы веществ: Масса реагирующих веществ равна массе продуктов реакции.
В химической реакции число взаимодействующих атомов остается неизменным, происходит только их перегруппировка с разрушением исходных веществ. Взаимодействие водорода и кислорода с образованием воды может быть записано с помощью уравнения химической реакции:
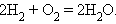
Коэффициенты перед формулами химических соединений называются стехиометрическими.
Закон постоянства состава (Ж. Пруст): Химическое соединение, имеющее молекулярное строение, независимо от метода получения характеризуется постоянным составом.
Закон кратных отношений (Д. Дальтон): Если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
При взаимодействии азота с кислородом образуются пять оксидов. На 1 грамм азота в образующихся молекулах приходится 0,57, 1,14, 1,71, 2,28, 2,85 грамм кислорода, что соответствует отношением 2:1, 1:1, 2:3, 1:2, 2:5 в этих оксидах; их составы N2O, NO, N2O3, NO2, N2O5.
Закон эквивалентов (И. Рихтер):В молекулярных соединениях массы составляющих их элементов относятся между собой как их эквиваленты.
Химический эквивалент – реальная или условная частица вещества, способная соединиться и заместить 1 моль атомов водорода в реакциях присоединения и замещения или принять (отдать) 1 моль электронов в окислительно-восстановительных реакциях.
Химический эквивалент:

| 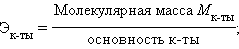
|

| 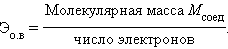
|
Закон простых объемных отношений (Ж. Гей-Люссак): При равных условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов как небольшие целые числа.
Так, в реакции образования аммиака из простых веществ отношение объемов водорода, азота и аммиака составляет 3:1:2.
Закон Авогадро: В равных объемах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул.
Из закона Авогадро вытекают два следствия:
1) Одинаковое число молекул любых газов при одинаковых условиях занимают одинаковый объем.
2) Относительная плотность одного газа по другому равна отношению их молярных масс.
Число Авогадро – число частиц в моле любого вещества; NA = 6,02∙1023 моль–1.
Молярный объем – объем моля любого газа при нормальных условиях; равен 22,4 л∙моль–1.
Молярная масса (M) – масса одного моля вещества, численно совпадающая с относительными массами атомов, ионов, молекул, радикалов и других частиц, выраженных в г∙моль–1.
 2014-02-24
2014-02-24 1943
1943