Исследуя изменение химических свойств элементов в зависимости от величины их относительной атомной массы (атомного веса), Д. И. Менделеев в 1869 г. открыл закон периодичности этих свойств: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомных весов элементов».
Физическая основа периодического закона была установлена в 1922 г. Бором. Поскольку химические свойства обусловлены строением электронных оболочек атома, периодическая система Менделеева – это естественная классификация элементов по элекронным структурам их атомов. Простейшая основа такой классификации – число электронов в нейтральном атоме, которое равно заряду ядра. Но при образовании химической связи электроны могут перераспределяться между атомами, а заряд ядра остается неизменным, поэтому современная формулировка периодического закона гласит: «Свойства элементов находятся в периодической зависимости от зарядов ядер их атомов».
Это обстоятельство отражено в периодической системе в виде горизонтальных и вертикальных рядов – периодов и групп.
Период – горизонтальный ряд, имеющий одинаковое число электронных слоев, номер периода совпадает со значением главного квантового числа n внешнего уровня (слоя); таких периодов в периодической системе семь. Второй и последующие периоды начинаются щелочным элементом (ns 1) и заканчивается благородным газом (ns 2 np 6).
По вертикали периодическая система подразделяется на восемь групп, которые делятся на: главные – А, состоящие из s - и p -элементов, и побочные – B-подгруппы, содержащие d -элементы. Подгруппа III B, кроме d -элементов, содержит по 14 4 f - и 5 f -элементов (4 f - и 5 f -семейства). Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы.
Сходство элементов внутри каждой группы – наиболее важная закономерность в периодической системе. Следует, кроме того, отметить такую закономерность, как диагональное сходство у пар элементов Li и Mg, Be и Al, B и Si и др. Эта закономерность обусловлена тенденцией смены свойств по вертикали (в группах) и их изменением по горизонтали (в периодах).
Сруктура электронной оболочки атомов элемента изменяется периодически с ростом порядкового номера элемента. С другой стороны, свойства определяются строением электронной оболочки и, следовательно, находятся в периодической зависимости от заряда ядра атома.
В 20-х годах XX столетия было установлено, что любая частица имеет корпускулярно-волновую природу. Согласно теории Л. де Бройля (1924 г.), каждой частице соответствует волновой процесс с длиной волны λ. Чем меньше масса частицы, тем больше длина волны. Для элементарных частиц В. Гейзенберг сформулировал принцип неопределенности, согласно которому невозможно одновременно определить положение частицы в пространстве и ее импульс. Следовательно, нельзя рассчитать траекторию движения электрона в поле ядра, можно лишь оценить вероятность его нахождения в атоме с помощью волновой функции ψ. Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ2 определяет пространственное распределение электрона в атоме. В наиболее простом варианте волновая функция зависит от трех пространственных координат и дает возможность определить вероятность нахождения электрона в атомном пространстве или его орбиталь. Таким образом, атомная орбиталь (АО) – область атомного пространства, в котором вероятность нахождения электрона наибольшая.
Атомная орбиталь и плотность электронного облака имеют одинаковую граничную поверхность (форму) и одинаковую пространственную ориентацию. Атомные орбитали электрона, их энергия и направление в пространстве зависят от четырех параметров – квантовых чисел.
Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He+, Li2+ и т. д.).
В этом случае энергия электрона n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном.
В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
Орбитальное квантовое числоl характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых l имеет буквенные обозначения
| l | = | … | |||||
| l | = | s | p | d | f | g | … |
Электроны с одинаковым значением l образуют подуровень.
Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от – l до + l через нуль, то есть 2 l + 1 значений. Расположение орбитали характеризуется значением проекции вектора орбитального момента количества движения Mz на какую-либо ось координат (обычно ось z).
Таблица 3 – Значения квантовых чисел и число орбиталей на энергетических подуровнях
| ||||||||||||||||||
Орбитали одного подуровня (l = const) имеют одинаковую энергию. Такое состояние называют вырожденным по энергии. Так p -орбиталь – трехкратно, d – пятикратно, а f – семикратно вырождены.
Граничные поверхности s -, p -, d -, f - орбиталей показаны на рис. 3.

|
Рисунок 3 - Изображение с помощью граничных поверхностей s -, p -, d - и f -орбиталей
s - Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально симметричная форма обусловлена тем, что при l = 0 и μ l = 0.
p - Орбитали существуют при n ≥ 2 и l = 1, поэтому возможны три варианта ориентации в пространстве: ml = –1, 0, +1. Все p-орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 90° друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются px, py, pz.
d - Орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором ml = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве. d -Орбитали, ориентированные лопастями по осям координат, обозначаются dz ² и dx ²– y ², а ориентированные лопастями по биссектрисам координатных углов – dxy, dyz, dxz.
Семь f - орбиталей, соответствующих l = 3 (n ≥ 4), изображаются в виде граничных поверхностей, приведенных на рис. 4.
Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установленно, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое числоms имеет только два значения ms = ±1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Электроны с разными ms обозначаются стрелками, направленными вверх 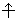 и вниз
и вниз 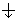 .
.
В многоэлектронных атомах, как и в атоме водорода, состояние электрона определяется значениями тех же четырех квантовых чисел, однако в этом случае электрон находится не только в поле ядра, но и в поле других электронов. Поэтому энергия в многоэлектронных атомах определяется не только главным, но и орбитальным квантовым числом, а вернее их суммой: энергия атомных орбиталей возрастает по мере увеличения суммы n + l; при одинаковой сумме сначала заполняется уровень с меньшим n и большим l. Энергия атомных орбиталей возрастает согласно ряду:
1 s < 2 s < 2 p < 3 s < 3 p < 4 s ≈ 3 d < 4 p < 5 s ≈ 4 d < 5 p < 6 s ≈ 4 f ≈ 5 d < 6 p < 7 s ≈ 5 f ≈ 6 d < 7 p.
Итак, четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.
Заселение электронами атомных орбиталей (АО) осуществляется согласно принципу наименьшей энергии, принципу Паули и правилу Гунда.
Принцип наименьшей энергии требует, чтобы электроны заселяли АО в порядке увеличения энергии элекронов на этих орбиталях. Это отражает общее правило – максимуму устойчивости системы соответствует минимум ее энергии.
Принцип Паули запрещает в многоэлектронном атоме находиться электронам с одинаковым набором квантовых чисел. Это означает, что два любых электрона в атоме (или молекуле, или ионе) должны отличаться друг от друга значением хотя бы одного квантового числа, то есть на одной орбитали может быть не более двух электронов с различными спинами (спаренных электронов). Каждый подуровень содержит 2l + 1 орбитали, на которых размещаются не более 2(2l + 1) электронов. Отсюда следует, что емкость s-орбиталей – 2, p-орбиталей – 6, d-орбиталей – 10 и f-орбиталей – 14 электронов.
Орбитали с одинаковыми энергиями (вырожденные) заполняются в соответствии с правилом Гунда: наименьшей энергией обладает электронная конфигурация с максимальным спином. Это означает, что если на p-орбитали три электрона, то они располагаются так: 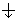
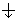
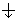 , и суммарный спин S = 3/2, а не так:
, и суммарный спин S = 3/2, а не так: 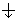
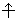
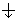 , S = 1/2.
, S = 1/2.
В записи электронных формул (или конфигураций), отражающих эту последовательность, первая цифра равна n, буква после нее соответствует l, а правый верхний индекс равен числу электронов в этом состоянии (табл. 2.1). Например, электронная формула лития – 1s22s1, углерода – 1s22s22p2, хлора – 1s22s22p63s23p5.
Заселенность электронных оболочек может быть представлена в виде квантовых ячеек (квадратов или горизонтальных линий) (рис. 4).
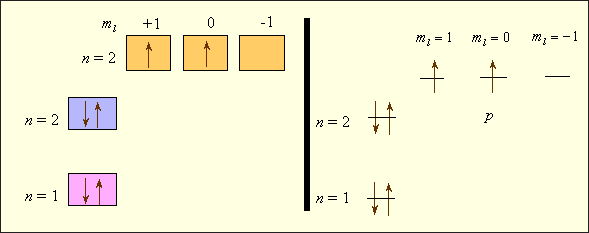
Рисунок 4 - Электронное строение атома углерода
Первый период (n = 1, l = 0) состоит из двух элементов H (1 s 1) и He (1 s 2).
Во втором периоде (n = 2, l = 0, 1) заполняются s - и p -орбитали от Li до Ne. Элементы называются соответсвенно s - и p -элементами.
В третьем периоде появляются пять d -орбиталей (n = 3, l = 0, 1, 2). Пока они вакантны, и третий период, как и второй, содержит восемь p -элементов элементов от Na до Ar.
Следующие за аргоном калий и кальций имеют на внешнем уровне 4 s -электроны (четвертый период). Появление 4 s -электронов при наличии свободных 3 d -орбиталей обусловлено экранированием ядра плотным 3 s 23 p 6-электронным слоем. В связи с отталкиванием от этого слоя внешних электронов для калия и кальция реализуются [Ar]4 s 1- и [Ar]4 s 2-состояния. Сходство K и Ca с Na и Mg соответственно, кроме чисто «химического» обоснования, подтверждается также электронными спектрами.
Из анализа зависимости энергии электрона от порядкового номера элемента В. М. Клечковский сформулировал правило, согласно которому энергия атомных орбиталей возрастает по мере увеличения суммы (n + l). При равенстве сумм сначала заполняется уровень с меньшим n и большим l, а потом с большим n и меньшим l. Так у K и Ca заполняется 4 s -орбиталь (4 + 0 = 4), а потом у Sc заполняется 3 d -орбиталь (3 + 2 = 5).
Пятый период повторяет четвертый – в нем также 18 элементов, и 4 d -элементы, как и 3 d образуют вставную декаду (4 d 1–105 s 0–2).
В шестом периоде после лантана (5 d 16 s 2) – аналога скандия и иттрия следуют 14 4 f -элементов – лантаноидов. Свойства этих элементов очень близки, поскольку идет заполнение глубоколежащего (n – 2) f -подуровня. Общая формула лантаноидов 4 f 2–145 d 0–16 s 2.
Ионы 4f-элементов образуются следующим образом:
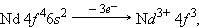
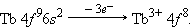
После 4 f -элементов заполняются 5 d - и 6 p -орбитали.
Седьмой период отчасти повторяет шестой. 5 f -элементы называются актиноидами. Их общая формула 5 f 2–146 d 0–17 s 2. Далее следуют еще 6 искусственно полученных 6 d -элементов незавершенного седьмого периода.
Электронные конфигурации атомов периодической системы представлены в табл. 4.
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром.
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек.
У s- и p-элементов изменение радиусов, как в периодах, так и в подгруппах более ярко, чем у d- и f-элементов, поскольку d- и f-электроны внутренние.
Образование ионов приводит к изменению ионных радиусов по сравнению с атомными. При этом радиусы катионов всегда меньше, а радиусы анионов всегда больше соответствующих атомных радиусов. Ковалентный радиус равняется половине межатомного расстояния в молекулах или кристаллах простых веществ.
Таблица 4 - Электронные конфигурации атомов периодической таблицы
|
В главных и побочных подгруппах свойства элементов меняются немонотонно, что обусловлено так называемой вторичной периодичностью, связанной с влиянием d- и f-электронных слоев.
Из анализа периодичности геометрических и энергетических параметров атомов следует, что периодическим законом можно пользоваться для определения физико-химических констант, предсказывать изменение радиусов, энергий ионизации и сродства к электрону, и, следовательно, кислотно-основные и окислительно-восстановительные свойства их соединений.
 2014-02-24
2014-02-24 2209
2209
