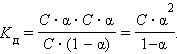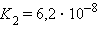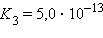Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
Движущими силами образования растворов являются энтропийный и энтальпийный факторы. При растворении газов в жидкости энтропия всегда уменьшается ΔS < 0, а при растворении кристаллов возрастает (ΔS > 0). Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов.
Для жидких растворов (расплавов) процесс растворения идет самопроизвольно до установления динамического равновесия между раствором и твердой фазой.
|
|
|
Концентрация насыщенного раствора определяется растворимостью вещества при данной температуре. Растворы с меньшей концентрацией называются ненасыщенными.
Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также от внешних условий (давления, температуры и т. д.)
В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие смеси в химии называют просто растворами. Наиболее широко применяемым неорганическим растворителем является вода. Растворы с другими растворителями называются неводными.
Растворы имеют чрезвычайно большое практическое значение, в них протекают многие химические реакции, в том числе и лежащие в основе обмена веществ в живых организмах.
Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
К безразмерным концентрациям (долям) относятся следующие концентрации:
Массовая доля растворенного вещества W (B) выражается в долях единицы или в процентах:
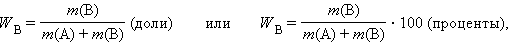
|
где m(B) и m(A) – масса растворенного вещества B и масса растворителя A.
Объемная доля растворенного вещества σ(B) выражается в долях единицы или объемных процентах:
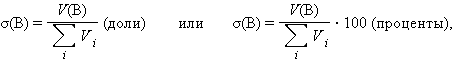
|
где Vi – объем компонента раствора, V(B) – объем растворенного вещества B. Объемные проценты называют градусами*).
*) Иногда объемная концентрация выражается в тысячных долях (промилле, ‰) или в миллионных долях (млн–1), ppm.
|
|
|
Мольная доля растворенного вещества χ(B) выражается соотношением
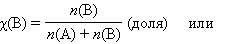 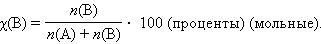
|
Сумма мольных долей k компонентов раствора χi равна единице 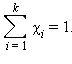
К размерным концентрациям относятся следующие концентрации:
Моляльность растворенного вещества Cm(B) определяется количеством вещества n(B) в 1 кг (1000 г) растворителя, размерность моль/кг.
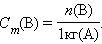
|
Молярная концентрация вещества B в растворе C (B) – содержание количества растворенного вещества B в единице объема раствора, моль/м3, или чаще моль/литр:
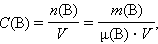
|
где μ(B) – молярная масса B, V – объем раствора.
Молярная концентрация эквивалентов вещества B C Э(B) (нормальность – устаревш.) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр–1:
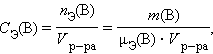
|
где nЭ(B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента.
Титр раствора вещества B( T B) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора:
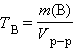 г∙мл–1 или г∙мл–1 или
| ||
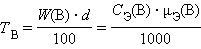 г∙мл–1. г∙мл–1.
|
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Все вещества в той или иной степени способны растворяться и характеризуются растворимостью. Некоторые вещества неограниченно растворимы друг в друге (вода-ацетон, бензол-толуол, жидкие натрий-калий). Большинство соединений ограниченно растворимы (вода-бензол, вода-бутиловый спирт, вода-поваренная соль), а многие малорастворимы или практически нерастворимы (вода-BaSO4, вода-бензин).
Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе. В таком растворе достигается равновесие между растворяемым веществом и раствором. В отсутствие равновесия раствор остается стабильным, если концентрация растворенного вещества меньше его растворимости (ненасыщенный раствор), или нестабильным, если в растворе содержится вещества больше его растворимости (пересыщенный раствор).
Растворение некоторых веществ сопровождается высвобождением или образованием ионов. При этом возможны диссоциативный и ионизационный механизмы. Диссоциативный механизм превалирует при разрушении ионной кристаллической решетки под воздействием сольватирующего растворителя.
Так, ионы, составляющие кристаллическую решетку KCl, приобретают способность проводить электрический ток в любом из двух случаев разрушения кристаллической решетки – под воздействием тепловой энергии (расплав) или под воздействием сольватирующего растворителя (растворение). В последнем случае в раствор переходят готовые ионы, окруженные молекулами растворителя. Процесс взаимодействия ионов кристаллической решетки с молекулами растворителя называется сольватацией.
Ионизационный механизм состоит в том, что в молекулах газообразных, твердых и жидких веществ под воздействием полярных молекул растворителя увеличивается доля ионности настолько, что в раствор могут переходить сольватированные ионы. В зависимости от природы растворителя электролит может быть полностью диссоциирован, либо будет вести себя как слабый электролит:
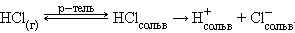
|
В воде равновесие смещено вправо и растворенный хлористый водород диссоциирован полностью. В бензоле растворенный HCl ведет себя как слабый электролит.
Важной характеристикой электролитов служит степень диссоциации α:
|
По величине степени диссоциации электролиты делятся на слабые и сильные. Для сильных электролитов, к которым относятся некоторые минеральные кислоты и щелочи, большинство солей, α > 30 %. К слабым относят некоторые минеральные кислоты (HNO2, HCN, H2SO3), большинство оснований, практически все органические кислоты.
|
|
|
Важнейшей характеристикой слабого электролита служит константа диссоциации.
Рассмотрим равновесную реакцию диссоциации слабого электролита HAn:
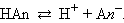
|
Константа равновесия K р этой реакции и есть K д:
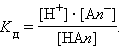
|
Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим:
|
Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α << 1 это уравнение упрощается:
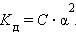
Тогда: 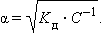
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации α стремится к единице.
Для слабых электролитов, к каковым относятся некоторые кислоты и основания, константа равновесия реакции диссоциации получила название константы диссоциации:
| Реакция | Константа диссоциации |
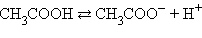
| 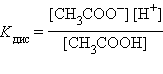
|
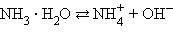
| 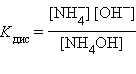
|
Поскольку эти константы – очень малые величины 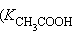 = 1,86∙10–5,
= 1,86∙10–5, 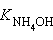 = 1,77∙10–5), их выражают через отрицательный десятичный логарифм: – lg Kдисс = pKдисс. Тогда pK приведенных выше констант составят pKк = 4,730 и pKосн = 4,752.
= 1,77∙10–5), их выражают через отрицательный десятичный логарифм: – lg Kдисс = pKдисс. Тогда pK приведенных выше констант составят pKк = 4,730 и pKосн = 4,752.
Многоосновные кислоты и многокислотные основания характеризуются соответствующим числом ступенчатых констант диссоциации:
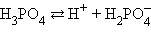
| 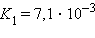
|
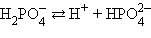
| 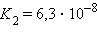
|
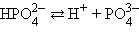
| 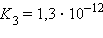
|
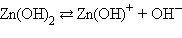
| 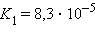
|
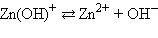
| 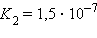
|
Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой. Так, трехосновная ортофосфорная кислота H3PO4 диссоциирует следующим образом:
| ||||||||||||
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
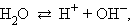
|
ее константа при 298 K равна
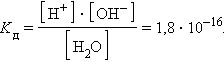
|
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
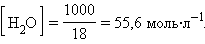
|
Отсюда произведение постоянных величин K д∙[H2O] = [H+]∙[OH–] = const.
|
|
|
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды K в, равна
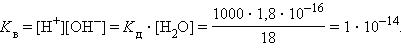
|
Таким образом, в пределах 15–25 °C ионное произведение воды K в = 10–14.
Равенство [H+] и [OH–] соответствует нейтральной среде [H+] = [OH–] = 1 ∙ 10–7, при [H+] > 1 ∙ 10–7 – кислой, при [H+] < 1 ∙ 10–7 – щелочной.
Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов: pH = –lg [H+].
Очевидно, –lg [H+][OH–] = –lg 1 ∙ 10–14 дает pH + pOH = 14.
Тогда pH < 7 указывает на кислую среду, pH > 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Поскольку pH + pOH = 14, можно видеть, что pH может меняться от небольших отрицательных значений до величин, немного превышающих 14 (pH NaOH c C = 2 равен 14,3).
Принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено вправо:
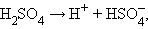
|
а потому константа равновесия (диссоциации) оказывается величиной неопределенной. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов.
Дебай и Хюккель, предложив модель, которая легла в основу теории сильных электролитов, постулировали:
1) Электролит полностью диссоциирует, но в сравнительно разбавленных растворах (C = 0,01 моль·л–1).
2) Каждый ион окружен оболочкой из ионов противоположного знака. В свою очередь, каждый из этих ионов сольватирован. Это окружение называется ионной атмосферой.
Сильный электролит полностью диссоциирует (α > 30%), но в сравнительно разбавленных растворах (C = 0,01 моль·л–1).
 2014-02-24
2014-02-24 5132
5132