Тема 1.5 Классификация неорганических соединений и их свойства
В настоящее время известно более 500 тысяч неорганических соединений, знать их формулы, названия, а тем более свойства практически невозможно. Для того чтобы легче ориентироваться в огромном многообразии химических веществ, все вещества разделены на отдельные классы, включающие соединения, сходные по строению и свойствам.
Первоначально все химические вещества делятся на простые и сложные.
Простые вещества подразделяются на металлы и неметаллы.
Помимо типичных металлов и неметаллов есть большая группа веществ, обладающая промежуточными свойствами, их называют металлоидами.
Сложные вещества подразделяются на четыре класса химических соединений: оксиды, основания, кислоты и соли. Эта классификация разработана выдающимися химиками XVIII–XIX веков Антуаном Лораном Лавуазье, Михаилом Васильевичем Ломоносовым, Йёнсом Якобом Берцелиусом, Джоном Дальтоном.
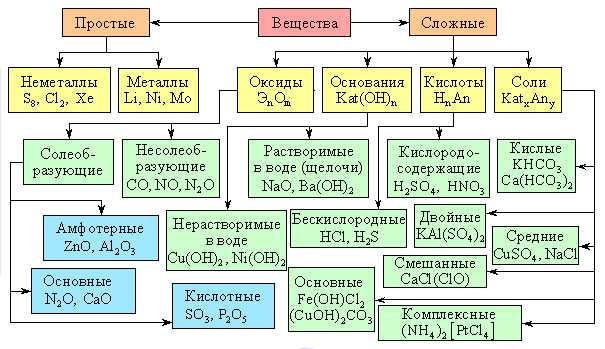
На рис. 8 приведены важнейшие классы неорганических соединений.
|
Рисунок 8 - Важнейшие классы неорганических соединений
Гидроксиды - тип сложных веществ, в состав которых входят атомы некоторого элемента Е (кроме фтора и кислорода) и гидроксогруппы ОН; общая формула гидроксидов Е(ОН) n, где n = 1÷6. Форма гидроксидов Е(ОН) n называется орто -формой; при n > 2 гидроксид может находиться также в мета -форме, включающей кроме атомов Е и групп ОН еще атомы кислорода О, например Е(ОН)3 и ЕО(ОН), Е(ОН)4 и Е(ОН)6 и ЕО2(ОН)2.
Гидроксиды делят на две противоположные по химическим свойствам группы: кислотные и основные гидроксиды.
Кислотные гидроксиды содержат атомы водорода, которые могут замещаться на атомы металла при соблюдении правила стехиометрической валентности. Большинство кислотных гидроксидов находится в мета -форме, причем атомы водорода в формулах кислотных гидроксидов ставят на первое место, например H2SO4, HNO3 и H2CO3, а не SO2(OH)2, NO2(OH) и CO(OH)2. Общая формула кислотных гидроксидов - Н х ЕО у, где электроотрицательную составляющую ЕО ух- называют кислотным остатком. Если не все атомы водорода замещены на металл, то они остаются в составе кислотного остатка.
Названия распространенных кислотных гидроксидов состоят из двух слов: собственного названия с окончанием «ая» и группового слова «кислота».
Названия кислот и кислотного остатка представлены в табл. Приложения А.
Названия кислотных остатков используют при построении названий солей.
Основные гидроксиды содержат гидроксид-ионы, которые могут замещаться на кислотные остатки при соблюдении правила стехиометрической валентности. Все основные гидроксиды находятся в орто -форме; их общая формула М(ОН) n, где n = 1,2 (реже 3,4) и М n +- катион металла. Примеры формул и названий основных гидроксидов:
| NaOH - гидроксид натрия | Ba(OH)2 - гидроксид бария |
| KOH - гидроксид калия | La(OH)3 - гидроксид лантана(III) |
Важнейшим химическим свойством основных и кислотных гидроксидов является их взаимодействие их между собой с образованием солей (реакция солеобразования), например:
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Соли - тип сложных веществ, в состав которых входят катионы М n + и кислотные остатки.
Соли с общей формулой М х (ЕО у) n называют средними солями, а соли с незамещенными атомами водорода, - кислыми солями. Иногда соли содержат в своем составе также гидроксид - или (и) оксид - ионы; такие соли называют основными солями. Приведем примеры и названия солей:
| Ca3(PO4)2 | - ортофосфат кальция |
| Ca(H2PO4)2 | - дигидроортофосфат кальция |
| CaHPO4 | - гидроортофосфат кальция |
| CuCO3 | - карбонат меди(II) |
| Cu2CO3(OH)2 | - дигидроксид-карбонат димеди |
| La(NO3)3 | - нитрат лантана(III) |
| Ti(NO3)2O | - оксид-динитрат титана |
Кислые и основные соли могут быть превращены в средние соли взаимодействием с соответствующим основным и кислотным гидроксидом, например:
Ca(HSO4)2 + Ca(OH) = CaSO4 + 2H2O
Ca2SO4(OH)2 + H2SO4 = 2CaSO4 + 2H2O
Встречаются также соли, содерхащие два разных катиона: их часто называют двойными солями, например:
| KAl(SO4)2 | - сульфат алюминия-калия |
Кислотные и оснόвные оксиды. Оксиды Е х О у - продукты полной дегидратации гидроксидов:
| H2SO4 ¾ ® SO3 - H2O | H2CO3 ¾ ® CO2 - H2O |
| NaOH ¾ ® Na2O - H2O | Ca(OH)2 ¾ ® CaO - H2O |
Кислотным гидроксидам (H2SO4, H2CO3) отвечают кислотные оксиды (SO3, CO2), а основным гидроксидам (NaOH, Ca(OH)2) - основные оксиды (Na2O, CaO), причем степень окисления элемента Е не изменяется при переходе от гидроксида к оксиду. Пример формул и названий оксидов:
| SO3 - триоксид серы | Na2O - оксид натрия |
| N2O5 - пентаоксид диазота | La2O3 - оксид лантана(III) |
| P4O10 - декаоксид тетрафосфора | ThO2 - оксид тория(IV) |
Кислотные и основные оксиды сохраняют солеобразующие свойства соответствующих гидроксидов при взаимодействии с противоположными по свойствам гидроксидами или между собой:
N2O5 + 2NaOH = 2NaNO3 + H2O
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O
La2O3 + 3SO3 = La2(SO4)3
Амфотерные оксиды и гидроксиды. Амфотерность гидроксидов и оксидов - химическое свойство, заключающееся в образовании ими двух рядов солей, например, для гидроксида и оксида алюминия:
(а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
(б) 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Так, гидроксид и оксид алюминия в реакциях (а) проявляют свойства основных гидроксидов и оксидов, т.е. реагируют с кислотными гидроксидам и оксидом, образуя соответствующую соль - сульфат алюминия Al2(SO4)3, тогда как в реакциях (б) они же проявляют свойства кислотных гидроксидов и оксидов, т.е. реагируют с основными гидроксидом и оксидом, образуя соль - диоксоалюминат (III) натрия NaAlO2. В первом случае элемент алюминий проявляет свойство металла и входит в состав электроположительной составляющей (Al3+), во втором - свойство неметалла и входит в состав электроотрицательной составляющей формулы соли (AlO2-).
Если указанные реакции протекают в водном растворе, то состав образующихся солей меняется, но присутствие алюминия в катионе и анионе остаётся:
2Al(OH)3 + 3H2SO4 = [Al(H2O)6]2(SO4)3
Al(OH)3 + NaOH = Na[Al(OH)4]
Здесь квадратными скобками выделены комплексные ионы [Al(H2O)6]3+ - катион гексаакваалюминия(III), [Al(OH)4]- - тетрагидроксоалюминат(III)-ион.
Элементы, проявляющие в соединениях металлические и неметаллические свойства, называют амфотерными, к ним относятся элементы А-групп Периодической системы - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., а также большинство элементов Б-групп - Cr, Mn, Fe, Zn, Cd, Au и др. Амфотерные оксиды называют так же, как и основные, например:
| BeO - оксид бериллия | FeO - оксид железа(II) |
| Al2O3 - оксид алюминия | Fe2O3 - оксид железа(III) |
| SnO - оксид олова(II) | MnO2 - оксид марганца(IV) |
| SnO2 - диоксид олова(IV) | ZnO - оксид цинка(II) |
Амфотерные гидроксиды (если степень окисления элемента превышает + II) могут находиться в орто - или (и) мета - форме. Примеры амфотерных гидроксидов:
| Be(OH)2 | - гидроксид бериллия |
| Al(OH)3 | - гидроксид алюминия |
| AlO(OH) | - метагидроксид алюминия |
| TiO(OH)2 | - дигидроксид-оксид титана |
| Fe(OH)2 | - гидроксид железа(II) |
| FeO(OH) | - метагидроксид железа |
Амфотерным оксидам не всегда соответствуют амфотерные гидроксиды, поскольку при попытке получения последних образуются гидратированные оксиды, например:
| SnO2 . n H2O | - полигидрат оксида олова(IV) |
| Au2O3 . n H2O | - полигидрат оксида золота(I) |
| Au2O3 . n H2O | - полигидрат оксида золота(III) |
Если амфотерному элементу в соединениях отвечает несколько степеней окисления, то амфотерность соответствующих оксидов и гидроксидов (а следовательно, и амфотерность самого элемента) будет выражена по-разному. Для низких степеней окисления у гидроксидов и оксидов наблюдается преобладание основных свойств, а у самого элемента - металлических свойств, поэтому он почти всегда входит в состав катионов. Для высоких степеней окисления, напротив, у гидроксидов и оксидов наблюдается преобладание кислотных свойств, а у самого элемента - неметаллических свойств, поэтому он почти всегда входит в состав анионов. Так, у оксида и гидроксида марганца(II) доминируют основные свойства, а сам марганец входит в состав катионов типа [Mn(H2O)6]2+, тогда как у оксида и гидроксида марганца(VII) доминируют кислотные свойства, а сам марганец входит в состав аниона типа MnO4-. Амфотерным гидроксидам с большим преобладанием кислотных свойств приписывают формулы и названия по образцу кислотных гидроксидов, например НMnVIIO4 - марганцовая кислота.
Таким образом, деление элементов на металлы и неметаллы - условное; между элементами (Na, K, Ca, Ba и др.) с чисто металлическими и элементами (F, O, N, Cl, S, C и др.) с чисто неметаллическими свойствами существует большая группа элементов с амфотерными свойствами.
1) Способы получения солей
Взаимодействие простых веществ
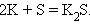
Взаимодействие оксидов
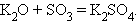
Взаимодействие кислот и оснований (нейтрализация)
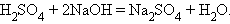
Взаимодействие соли и кислоты
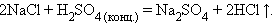
Взаимодействие соли и щелочи
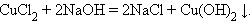
Взаимодействие двух солей (обменная реакция)
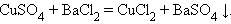
Взаимодействие оксида с кислотой
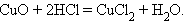
Замещение водорода
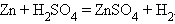
Замещение металла
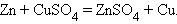
Термолиз кислых солей
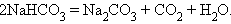
Взаимодействие двух солей (присоединение)
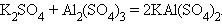
Взаимодействие двух солей (комплексообразование)
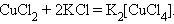
Окисление простых и сложных веществ
S + O2 = SO2; 2Mg + O2 = 2MgO,
2CuS +3O2 = 2CuO + 2SO2.
Разложение гидроксидов
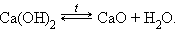
Разложение карбонатов и других солей
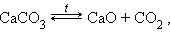

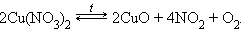
Взаимодействие металла с другим оксидом
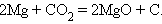
 2014-02-24
2014-02-24 2216
2216
