ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ДИСПЕРСИОННОЙ СРЕДЫ УДС
ЛЕКЦИЯ №5
СИСТЕМЫ
ДИСПЕРСНЫЕ
УГЛЕВОДОРОДНЫЕ
Изучение жидкостей показывает, что они обладают некоторой внутренней упорядоченностью, которая не так сильно выражена, как у твердых тел. В то же время модель бесструктурного газа для описания жидкостей неприменима. По внутренней структуре жидкости занимают промежуточное положение между твердыми телами и газами. Нередко жидкости представляются как разупорядоченное твердое тело, например кристалл, часть ячеек которого не заполнена. Поскольку в жидкости молекулы находятся близко друг к другу, их внутреннее строение и свойства оказывают существенное влияние на свойства жидкости в целом.
Наиболее последовательно модель строения жидкости развита Я.И. Френкелем и Г. Эйрингом. Их «дырочная» модель основывается на допущении существования в жидкости свободных полостей («дырок»). Размеры полости таковы, что молекула может внедриться в них. Близость по значению кинетической и потенциальной энергий обусловливает возможность молекуле «перескакивать» в расположенные по соседству «дырки». Положения равновесия не абсолютно неизменны (в среднем) как в твердом теле, а имеют временной характер. Молекула колеблется вблизи положения равновесия в течение некоторого времени τ0 (время колебания в равновесном положении), затем она перескакивает в новое положение равновесия, находящееся на расстоянии порядка межмолекулярных расстояний. Появляется характерное время «перескока» τ, сопоставимое с периодом колебаний вблизи положения равновесия τ0. В энергетическом отношении такие молекулы находятся в потенциальных ямах и отделены от другого возможного положения равновесия энергетическим барьером. За счет того, что какая-либо молекула будет обладать достаточной энергией, она может перескакивать в находящиеся рядом «дырки», занимая новое положение равновесия. Одновременно происходит скачок «дырки» с созданием возможности перескока другим молекулам жидкости. Число возможных скачков определяется числом «дырок» и высотой энергетического барьера, преодолеваемого молекулой при перескоке из одного положения в другое.
Переход молекулы из одного равновесного положения в другое рассматривается как последовательность двух актов: «испарения» из исходного в промежуточное состояние с возрастанием потенциальной энергии взаимодействия на некоторую величину ∆На,называемой энергией активации, и «конденсация» их промежуточного положения в новое положение равновесия с мгновенной передачей избыточной кинетической энергии, в которую переходит энергия активации. При этом исключается возможность возвращения в исходное состояние. Зависимость времени жизни от температуры Т представляется в виде:
τ = τ0 e – ∆На / kT,
где τ0 = l/ν0 — время колебания молекулы в равновесном положении (величина, обратная частоте колебаний ν0); k — постоянная Больцмана.
Предэкспоненциальный множитель в такой интерпретации получает значение среднего числа колебаний, совершаемых молекулой до перескока в соседнее равновесное положение. Временем жизни τ определяется скорость перемещения молекул
ω = d /τ = (d /τ0) e – W / kT,
здесь d имеет смысл «эффективного» расстояния между двумя положениями равновесия.
В случае чистой жидкости ∆На определяется энергией потенциального взаимодействия между ее молекулами. Следовательно, тепловое движение молекул жидкости частично состоит из колебательных движений вблизи положений равновесия и поступательных движений из одного положения равновесия в другое в результате соударений с соседями. Соотношение между временем жизни и дрейфа определяется энергией активации ∆На и температурой Т. С ростом температуры происходит уменьшение τ и приближение его к значениям τ0. Роль поступательного движения при этом усиливается, а колебательного — ослабляется. Жидкость по своей структуре начинает приближаться к газу. При низких температурах, когда наблюдается в основном «оседлый» образ жизни, структура жидкостей более близка к твердым телам. Результатом теплового движения молекул является их взаимное перемешивание. Такое явление называют самодиффузией, а коэффициент самодиффузии D определяют следующим образом:
D = d 2/(6τ) = d 2/(6τ0) e – W / kT,
Согласно Я. И. Френкелю, если молекулы растворенного вещества достаточно велики, то они являются равноправными участниками (наряду с молекулами растворителя) теплового движения. В этом случае теряется смысл величины энергии активации, поскольку молекулы растворенного вещества не участвуют в перескоках по дырочному механизму. Если размер молекул растворенного вещества сопоставим с размерами молекул растворителя, то понятие энергии активации приобретает смысл, но значение ее определяется величиной и характером межмолекулярных взаимодействий в среде. При этом оказывается, что значения энергий активации, отнесенные к молекулам растворителя и растворенного вещества, близки.
Текучесть жидкостей зависит от характерного времени воздействия внешней силы и проявляется как суммарный эффект большого числа молекулярных переходов между временными положениями равновесия. Наличие внешней силы снижает энергию активации ∆На.
Созданная Я.И. Френкелем теория качественно правильно описывает процессы, происходящие в жидкостях, молекулы которых достаточно малы. Критерием применимости теории является относительно небольшое, порядка 101—102, число степеней свободы отдельной молекулы. В случае малых молекул характерные межмолекулярные расстояния соизмеримы с их линейными размерами.
В жидких нефтяных системах размеры молекул растворенных веществ могут значительно отличаться от размеров молекул растворителя. В настоящее время в литературе принято называть молекулы с числом степеней свободы порядка 103—106 макромолекулами. Описание теплового движения макромолекул в растворах усложняется. Указанное отличие низкомолекулярных соединений от высокомолекулярных по числу степеней свободы может служить дополнением к классификации молекул по их физико-химическим свойствам.
При анализе растворов высокомолекулярных соединений в тепловом движении участвуют не только молекулы как целое, но и фрагменты молекул. Кроме поступательного и вращательного движений нужно учесть колебания и относительное вращение всех звеньев макромолекулы друг относительно друга. Появляющиеся дополнительные внутренние степени свободы являются причиной отличия поведения растворов высокомолекулярных соединений от растворов низкомолекулярных соединений.
Рассмотренные выше подходы во многом являются качественными, описывающими тепловое движение молекул в любой жидкости. Естественно, что размеры и форма молекул, и в большей степени характер и интенсивность межмолекулярного взаимодействия, будут определять характер относительного расположения и относительного движения молекул жидкости. Для различных типов жидких веществ они могут оказаться различными.
Тепловое движение молекул растворителя является причиной броуновского движения молекул растворенного вещества. Сущность его заключается в том, что о «поверхность» молекулы непрерывно ударяются другие молекулы жидкости, например, растворителя. При каждом ударе молекуле передается некоторый импульс. Удары происходят беспорядочно во времени и по направлению. Частота толчков соответствует по порядку величины частоте тепловых колебаний молекул растворителя, т. е. составляет 1012 ударов в секунду. Броуновское движение отражает тепловое движение молекул жидкости (газа).
Существует также мнение, что модели броуновского движения неприменимы к молекулярным системам. Это связано с тем, что, во-первых, между молекулами существуют физические или химические связи, т.е. движение отдельных молекул не является независимым. Во-вторых, теории броуновского движения не учитывают геометрического строения молекул растворителя и растворенного вещества. В-третьих, молекулы не являются твердыми частицами, а состоят из атомов, связанных химическими связями. Существуют внутренние степени свободы, также дающие вклад в тепловое движение. Удар молекулы и соответствующая передача энергии может быть перераспределена между другими степенями свободы. Однако такая точка зрения не является общепризнанной. Уравнения, описывающие броуновское движение, применимы вплоть до молекулярных размеров (10–10 м). Уравнения броуновского движения описывают также вращение частиц в результате соударений, позволяя определять их размеры.
5.3. Вязкость.
Вязкость (η) жидкостей проявляется при перемещении в потоке слоев жидкости друг относительно друга с различной скоростью. Основной закон вязкого течения установлен Ньютоном:
F = η S (dυ / dx),
где F — тангенциальная сила, вызывающая сдвиг слоев друг относительно друга; S — площадь слоя; dυ / dx — градиент скорости (скорость изменения скорости от слоя к слою); η – коэффициент вязкости (или просто вязкость).
Коэффициент пропорциональности η называется динамической вязкостью. Величина, обратная η, называется текучестью. Часто в технических расчетах используется кинематическая вязкость:
η/ d = ν,
где d — плотность жидкости.
Жидкости, подчиняющиеся закону Ньютона для течения, называются ньютоновскими. В жидкостях вязкость обусловлена межмолекулярными взаимодействиями. Следует отметить, что даже нефтяные молекулярные растворы не всегда являются ньютоновскими жидкостями. Изучение неньютоновского поведения нефтей и нефтепродуктов представляет значительный интерес как в теоретическом, так и в прикладном отношении.
Коэффициент вязкости характеризует скорость уменьшения различия в макроскопическом движении; он пропорционален коэффициенту диффузии или самодиффузии, являющемуся мерой скорости перемешивания частиц. Выражение для вязкости имеет вид
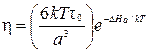 .
.
Экспериментальные методы изучения вязкостных свойств систем весьма разнообразны. Как отмечалось выше, межмолекулярные взаимодействия в сложных углеводородных системах, к которым относятся нефтяные, представляют собой слабые ван-дер-ваальсовы взаимодействия. Нередко это приводит к развитию молекулярной ассоциации.
Наиболее это характерно для нефтяных масел и индивидуальных масляных углеводородов. Они обладают аномально высокой зависимостью вязкости от температуры. Оказывается, что экспериментальные значения вязкости выше расчетных примерно на порядок. Это означает, что углеводородные жидкости сильно ассоциированы. Вязкость их определяется двумя составляющими: молекулярной и ассоциативной. И тот, и другой компонент зависят от химического строения молекул жидкости и энергий их межмолекулярного взаимодействия. Сопоставление молекулярной и ассоциативной динамической вязкости для некоторых углеводородов показано в табл. 9.
Таблица 9
Молекулярная (Δηm) и ассоциативная составляющие (Δηa) динамической вязкости (η) неполярных жидкостей
| Жидкость | 323 К | 293 К | ||||
| η | Δη м | Δη а | η | Δη м | Δη а | |
| н -Ундекан | 1.06 | 0.49 | 0.51 | 1.6 | 0.5 | 0.5 |
| н -Гексадекан | 2.46 | 0.4 | 0.6 | 4.46 | 0.25 | 0.75 |
| н -Эйкозан | 4.25 | 0.24 | 0.76 | — | — | — |
| 7,12-Диметил-9,10- н -Гексилоктадекан | 14.3 | 0.17 | 0.83 | 48.3 | 0.1 | 0.9 |
Вследствие того, что ван-дер-ваальсовы силы достаточно слабы, для реологических свойств становятся важными энтропийный фактор и стерические препятствия межмолекулярным взаимодействиям.
Отклонение от теоретических зависимостей возможно не только вследствие ассоциирования молекул растворителя, но и различия размеров молекул растворенного вещества и растворителя. Согласно Эйнштейну, вязкость раствора зависит от отношения объема растворенного вещества к объему растворителя (объемной доли φ) и не зависит от объема частиц растворенного вещества:
η = η0(1 + αφ),
где η — вязкость раствора; η0 — вязкость растворителя; α — константа для сферических частиц, равная 2.5.
В случае частиц произвольной формы αявляется функцией безразмерных геометрических параметров. При выводе формулы были сделаны следующие предпосылки: молекулы растворенного вещества значительно больше молекул растворителя и много меньше линейных размеров вискозиметра; отсутствие взаимодействия молекул растворенного вещества друг с другом; частицы распределены беспорядочно и равномерно. Течение раствора является ламинарным. Увеличение концентрации растворенного вещества приводит к появлению членов более высокого порядка по φ.
 2014-02-09
2014-02-09 2159
2159







