«Энтропия мира стремится к максимуму». Клаузиус, 1865 г.
Первый закон (постулат) термодинамики в энергетическом походе, когда внутренняя энергия является основной функцией состояния системы (см. уравнение 1) определяет баланс внутренней энергии в любой системе и процессе, но не указывает возможность и направление, в котором может осуществляться термодинамический процесс. Возможность прохождения и направленность термодинамических процессов определяется вторым законом (постулатом) термодинамики, вывод которого потребовал введения, наряду с энергией, второй важнейшей фундаментальной и универсальной физической величины - энтропии., являющаейся в данном подходе независимым параметром функции состояния системы. Введение этого параметра было обусловлено тем фактом, что формы энергии более высокого порядка (механическая, химическая, электрическая, ядерная и т.п.) и работы (Wр,W σ ,WЕ,WН,WА.) могут превращаться в консервативную тепловую энергию без остатка, но сама теплота не может превращаться полностью в другие формы энергии или в работу. Не существует двигателей, систем или процессов, которые бы преобразовывали теплоту в другую форму энергии или работу на 100%. Часть теплоты необратимо деградирует в наиболее примитивную форму энергии различных форм теплового движения атомов, молекул и других частиц, являющегося беспорядочным случайным (вероятностным) процессом, т.е. необратимо рассеивается внутри системы или передается в окружающую среду, повышая их температуру.
Энтропия S была введена Клаузиусом в классической технической термодинамике на основе подробного анализа изменения (преобразования) теплоты dQ в изолированных системах при обратимом процессе с использованием абсолютной шкалы температуры Т. Задав точку отсчета 0, для любого произвольного состояния Х Клаузиус определил функцию состояния S как интеграл от 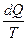 для обратимого процесса, преобразующего состояние 0 в состояние Х:
для обратимого процесса, преобразующего состояние 0 в состояние Х: 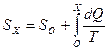 . Он назвал эту функцию энтропией – производным от греческого слова, обозначающего «преобразование». При этом в обратимом процессе полное изменение энтропии (интеграл от полного дифференциала
. Он назвал эту функцию энтропией – производным от греческого слова, обозначающего «преобразование». При этом в обратимом процессе полное изменение энтропии (интеграл от полного дифференциала 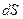 ), также как и энергии, зависит только от начального и конечного состояния:
), также как и энергии, зависит только от начального и конечного состояния: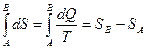 , где SА и SВ – значения энтропии в состояниях А и В.
, где SА и SВ – значения энтропии в состояниях А и В.
С точки зрения молекулярно-кинетических представлений статистической физики энтропия любой системы определяется числом микросостояний Ω, соответствующих данному макросостоянию, т.е. с числом способов комбинирования всех первичных элементов системы, и связана с ним соотношением Больцмана: S=kБlnΩ. Число микросостояний в любой системе резко возрастает с увеличением беспорядка в распределении ее первичных элементов (порядка симметрии), поэтому часто говорят, что энтропия является мерой беспорядка, а ее приращение приводит к возрастанию беспорядка в системе или в окружающей среде, т.е. каждая система стремится к переходу из менее вероятного высокоупорядоченного состояния в более вероятные (с хаотическим распределением частиц) состояния. Можно сказать, что каждая система характеризуется тенденцией самопроизвольного перехода к состоянию максимального молекулярного беспорядка или хаоса.
В классической равновесной термодинамикевторой основной постулат (закон) формулируется в виде равенства Клаузиуса:
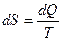 (2).
(2).
При этом введение понятия энтропии в идеализированном обратимом процессе (пути) со скоростью, стремящейся к нулю, как некомпенсированное преобразование, произведенное необратимыми процессами внутри системы в ходе обратимого процесса, позволило включить необратимые процессы в формализм равновесной термодинамики в виде неравенств Клаузиуса: 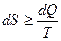 или
или 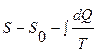 >0, где S и S0 – энтропия конечного и начального состояний соответственно; -
>0, где S и S0 – энтропия конечного и начального состояний соответственно; -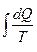 - уменьшение (вывод) приращенной в результате некомпенсированного преобразования энтропии за счет теплообмена с внешней средой.
- уменьшение (вывод) приращенной в результате некомпенсированного преобразования энтропии за счет теплообмена с внешней средой.
В современной термодинамике, включающей описание неравновесных состояний и необратимых процессов, постулируется, что в любом процессе происходит приращение энтропии за счет внутреннего преобразования теплоты в системе 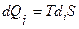 , которое всегда положительно (diS>0 ). Поэтому в изолированных системах при отсутствии теплообмена и обмена других форм энергии или вещества с окружающей средой энтропия системы в результате любых процессов возрастает (dS>0, достигая максимального значения, соответствующего равновесному состоянию. При этом энтропия остается постоянной (dS=0) только в специфическом обратимом адиабатическом процессе (
, которое всегда положительно (diS>0 ). Поэтому в изолированных системах при отсутствии теплообмена и обмена других форм энергии или вещества с окружающей средой энтропия системы в результате любых процессов возрастает (dS>0, достигая максимального значения, соответствующего равновесному состоянию. При этом энтропия остается постоянной (dS=0) только в специфическом обратимом адиабатическом процессе (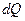 =0). Самопроизвольное стремление изолированных систем к равновесному состоянию с максимумом энтропии служит одной из классических формулировок 2-го закона термодинамики. По этой причине приведенное выше изречение Клаузиуса об энтропии, также как и об энергии, верно, если считать нашу Вселенную изолированной системой. В закрытых и открытых системах, способных обмениваться с окружающей средой, соответственно, только энергией (теплотой и работой) или энергией и веществом, может происходить также обмен энтропией с окружающей средой (dеS ) в виде теплоты
=0). Самопроизвольное стремление изолированных систем к равновесному состоянию с максимумом энтропии служит одной из классических формулировок 2-го закона термодинамики. По этой причине приведенное выше изречение Клаузиуса об энтропии, также как и об энергии, верно, если считать нашу Вселенную изолированной системой. В закрытых и открытых системах, способных обмениваться с окружающей средой, соответственно, только энергией (теплотой и работой) или энергией и веществом, может происходить также обмен энтропией с окружающей средой (dеS ) в виде теплоты 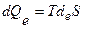 . Приращенная энтропия может выводиться из системы в результате диссипативных процессов необратимого превращения работы в теплоту за счет различных типов трения или в результате обмена веществом, и в зависимости от типа системы и протекающего процесса энтропия системы в целом может возрастать или уменьшаться и, соответствен, знак общего изменения энтропии системы может быть как положительным, так и отрицательным. Следовательно, в таких системах приращение энтропии является мерой необратимого рассеяния (диссипации) энергии, и dQi=ТdiS есть та теплота, которая необратимо рассеивается (диссипирует) в любом процессе. С другой стороны, это приращение является мерой той энергии, которая не может быть превращена в работу в любом процессе и не может изменить внутреннюю энергию системы.
. Приращенная энтропия может выводиться из системы в результате диссипативных процессов необратимого превращения работы в теплоту за счет различных типов трения или в результате обмена веществом, и в зависимости от типа системы и протекающего процесса энтропия системы в целом может возрастать или уменьшаться и, соответствен, знак общего изменения энтропии системы может быть как положительным, так и отрицательным. Следовательно, в таких системах приращение энтропии является мерой необратимого рассеяния (диссипации) энергии, и dQi=ТdiS есть та теплота, которая необратимо рассеивается (диссипирует) в любом процессе. С другой стороны, это приращение является мерой той энергии, которая не может быть превращена в работу в любом процессе и не может изменить внутреннюю энергию системы.
Таким образом, основной концепцией современной обобщенной термодинамики, применимой к описанию равновесных и неравновесных состояний, обратимых и необратимых процессов, является формулировка второго постулата (закона) термодинамики в виде положительных значений приращения и скорости приращения (производства) энтропии (diS>0 и diS/dt>0 соответственно) в результате любых процессов, протекающих внутри системы, т.е. все реальные процессы (в том числе в биологических системах), сопровождаются необратимым рассеянием (диссипацией) некоторой части энергии в виде тепловой энергии хаотического движения, которая не может быть превращена в работу.Поэтому, согласно этим представлениям, любой самопроизвольный (спонтанный) реальный процесс, происходящий в термодинамической системе, может осуществляться только в одном направлении (во времени – от прошлого к будущему, что соответствует так называемой стреле времени). Противоположный процесс, при котором как система, так и окружающая среда возвращались бы в их первоначальные состояния, невозможен, т.е. любой реальный процесс является в той или иной мере необратимым. При этом общее изменение энтропии в системе складывается из ее приращения, обусловленного необратимыми процессами внутри системы, которое всегда положительно (diS>0 и diS/dt> 0), и ее изменения вследствие обмена энергией и веществом с окружающей средой dеS, которое может быть как положительным, так и отрицательным: dS=dеS+diS. В равновесном, термодинамически стабильном состоянии, когда все процессы прекращаются, приращение и скорость приращения (производства) энтропии равны нулю (diS=0 и diS/dt=0), а при достижении стабильного (установившегося) состояния необратимых процессов переноса при заданных градиентах термодинамических параметров они имеют минимальные значения (см. раздел, посвященный основам неравновесной термодинамики).
 2014-02-09
2014-02-09 1481
1481
