В классической (химической) термодинамике при энергетическом подходе в дополнение к основной термодинамической функции состояния (U), являющейся функцией интенсивных независимых переменных, дополнительно введены очень важные характеристические функции состояния, так называемые термодинамические потенциалы (свободная энергия Гельмгольца F и свободная энергия Гиббса G) как движущие силы процессов установления равновесия и факторы, определяющие устойчивость равновесного состояния и указывающие направление любого процесса, протекающего в системе. Необходимость введения этих функций обусловлена тем, что анализ фундаментального уравнения Гиббса показывает, что свойства характеристической функции присуще не внутренней энергии и энтропии как таковым, т.е. не им, как функциям любых независимых переменных, а всему фундаментальному уравнению с выбранным набором экстенсивных независимых переменных. Так, если внутреннюю энергию представить не как функциютрех экстенсивных независимых переменных U=U(S,V,Nk), соответствующую фундаментальному уравнению, а заменить в ней в качестве независимой переменной неопределяемую экспериментально энтропию и/или трудно поддерживаемый постоянным в случае конденсированных фаз объем V на легко измеряемые и контролируемые интенсивные переменные T и/или р, являющиесяпервыми частными производными функций состояния U и S по соответствующим экстенсивным независимым переменным (S,V), сохранив в качественезависимой переменной легко варьируемую экстенсивную величину Nk, то полученная функция не является характеристической, т.е.из нее частным дифференцированием нельзя получить все термодинамические сведения о данной системе. Так, если функцию U(S,V,Nk) заменить на часто используемые на практике U(T,р,Nk) или U(T,V,Nk), тодифференциалы последних представляют собой дифференциальные уравнения первого порядка в частных производных по выбранным переменным, которые не эквивалентны фундаментальному уравнению U(S,V,Nk) в аналогичной форме. Так, полный дифференциал функции U(T,V,N)k:
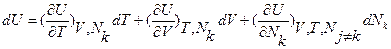 ,
,
не эквивалентен фундаментальному уравнению U(S,V,Nk) в дифференциальной форме: 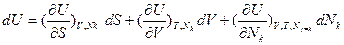 , так как решение первого уравнения по всем переменным для U(T,V,Nk) содержит произвольную функцию. Из этого следует, что из фундаментального уравнения, где U является функцией трех экстенсивных параметров U(S,V,Nk), можно получить U как функцию двух экстенсивных и одного интенсивного параметров U(Т,V,Nk), а, наоборот, из функции U(Т,V,Nk) получить фундаментальное уравнение U(S,V,N, ) невозможно, т.е. функция U(Т,V,Nk) не является характеристической.
, так как решение первого уравнения по всем переменным для U(T,V,Nk) содержит произвольную функцию. Из этого следует, что из фундаментального уравнения, где U является функцией трех экстенсивных параметров U(S,V,Nk), можно получить U как функцию двух экстенсивных и одного интенсивного параметров U(Т,V,Nk), а, наоборот, из функции U(Т,V,Nk) получить фундаментальное уравнение U(S,V,N, ) невозможно, т.е. функция U(Т,V,Nk) не является характеристической.
Получение функций состояния от одной или нескольких легко измеряемых интенсивных (T и/или р) и экстенсивных (Nk) переменных с сохранением всех термодинамических сведений о данной системе возможно при использовании преобразования фундаментального уравнения, называемого преобразованием Лежандра, позволяющего получить новые однозначные характеристические функции состояния. Преобразование Лежандра заключается в преобразовании функции у=у(х) в функцию φ=φ(р) при р=dy/dx. Преобразованием поднаборапеременных x1, …, xr функции у=у(х) из их полного набора x1, …, xr,…, xn, т.е.функции у (x1, …, xr,…, xn) в φ=φ(р1, …, рr, xr+1,…, xn) (r –кратное преобразование), где рi= 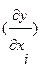 , -xi=dφ/dpi,(i<r), рj=
, -xi=dφ/dpi,(i<r), рj= 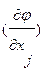 (j>r),
(j>r), 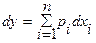 , дает:
, дает: 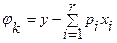 и
и 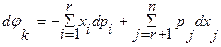 . Достаточным условием такого преобразования является
. Достаточным условием такого преобразования является 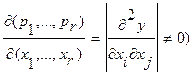 (i,j≤r).
(i,j≤r).
В результате r –кратного преобразования Лежандра фундаментального уравнения Гиббса для k -компонентной системы в энергетическом выражении U(S,V,N1,…,Nk) в обобщенных величинах экстенсивных (Xi) и интенсивных (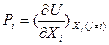 ) параметров в интегральной (
) параметров в интегральной (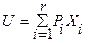 ) и в дифференциальной (
) и в дифференциальной (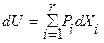 ) форме, где r ≥ k+2 – число экстенсивных параметров, получается обобщенное выражение для термодинамических потенциалов в интегральной форме:
) форме, где r ≥ k+2 – число экстенсивных параметров, получается обобщенное выражение для термодинамических потенциалов в интегральной форме: 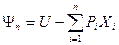 . Это выражение является гомогенной функцией 1-й степени (l=1), т.е. экстенсивной характеристической функцией состояния и обладает полной термодинамической информацией о системе. Аналогичное преобразование фундаментального уравнения в энтропийном выражении дает в результате функции, называемые функциями Массье-Планка, соответствующие термодинамическим потенциалам. Эти функции на практике обычно не применяются и имеют только историческое значение.
. Это выражение является гомогенной функцией 1-й степени (l=1), т.е. экстенсивной характеристической функцией состояния и обладает полной термодинамической информацией о системе. Аналогичное преобразование фундаментального уравнения в энтропийном выражении дает в результате функции, называемые функциями Массье-Планка, соответствующие термодинамическим потенциалам. Эти функции на практике обычно не применяются и имеют только историческое значение.
Термодинамический потенциал в дифференциальной обобщенной форме записывается в виде: 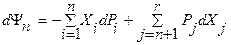 , где r – число экстенсивных параметров, а n – число независимых переменных.. Он является полным дифференциалом и его частные производные по интенсивным параметрам Pi дают (с отрицательным знаком) сопряженные экстенсивные параметры Xi (
, где r – число экстенсивных параметров, а n – число независимых переменных.. Он является полным дифференциалом и его частные производные по интенсивным параметрам Pi дают (с отрицательным знаком) сопряженные экстенсивные параметры Xi (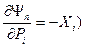 , а по экстенсивным параметрам Xj (как и в случае фундаментального уравнения) - сопряженные интенсивные параметры (
, а по экстенсивным параметрам Xj (как и в случае фундаментального уравнения) - сопряженные интенсивные параметры (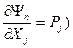 . В особом случае, когда n=r получается уравнение Гиббса-Дюгема в обобщенных параметрах состояния.
. В особом случае, когда n=r получается уравнение Гиббса-Дюгема в обобщенных параметрах состояния.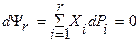 . Это уравнение показывает, что характеристические уравнения, способные дать полную термодинамическую информацию о системе, не могут содержать только интенсивные параметры, необходим хотя бы один экстенсивный параметр.
. Это уравнение показывает, что характеристические уравнения, способные дать полную термодинамическую информацию о системе, не могут содержать только интенсивные параметры, необходим хотя бы один экстенсивный параметр.
 2014-02-09
2014-02-09 1378
1378
