РАВНОВЕСИЕ ФАЗ
Вещества, применяемые в качестве рабочих тел, при осуществлении процессов могут находиться в состоянии одной или разных фаз. К первой группе относятся газы, а ко второй – вода, ртуть, иод и др.
Всякое вещество может находиться в различных фазах, которые могут представлять собой различные агрегатные состояния вещества. Каждая из фаз представляет собой однородную систему с одинаковыми физическими свойствами во всех ее частях. Характерной особенностью фазы является наличие границ, отделяющих различные соприкасающиеся между собой фазы.
Вещество может переходить из одной фазы в другую; этот переход носит название фазового перехода или фазового превращения.
Переход вещества из конденсированной (т. е. твердой или жидкой) фазы в газообразную называется испарением или парообразованием (а в случае твердого тела, кроме того,— сублимацией), обратный переход называется конденсацией; переход из твердой фазы в жидкую называется плавлением, а обратный переход из жидкой фазы в твердую — затвердеванием или кристаллизацией.
Переход чистого вещества из одной фазы в другую при данном давлении происходит при вполне определенной температуре; так, например, плавление льда при атмосферном давлении происходит при температуре 0° С.
При температуре фазового перехода в системе будут существовать и соприкасаться друг с другом две, а в некоторых случаях (точка тройного равновесия), при вполне определенной температуре — три фазы вещества.
Равновесное существование отдельных соприкасающихся между собой фаз вещества, способных превращаться одна в другую, называется фазовым равновесием.
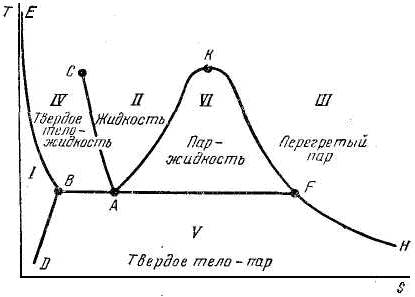
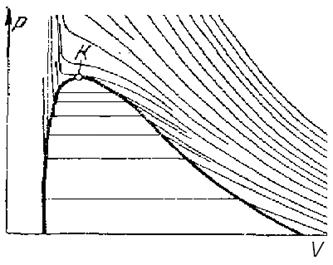
На Ts -диаграмме по оси абсцисс откладываются значения удельной (отнесённой к 1 кг массы) энтропии s данного вещества, а по оси ординат—абсолютная температура Т.
Ts-диаграмма обладает тем преимуществом, что обратимый адиабатический (или изоэнтропический) процесс изображается на этой диаграмме вертикальной прямой линией, а изотермический процесс — горизонтальной прямой линией.
 |
| Рис. 1. Ts –диаграмма вещества |
На плоскости Т — s наносятся сетки изобар (линии p(s, T) = const) и изоэнтальпии (линии i(s, Т) = const), а иногда и изохор (линии v(s, Т) = const. Кроме того, на Ts -диаграмме наносится пограничная кривая, т. е. кривая насыщения, а в области двухфазного состояния вещества жидкость — пар проводятся кривые постоянной степени сухости.
Общий вид Ts -диаграммы показан на рис.1.:
- область I представляет собой область твердого состояния вещества;
- область IV — область равновесного сосуществования твердой и жидкой фаз;
- область II — область жидкости;
- область V- — область равновесного сосуществования твердой и паровой фаз;
- область VI — область равновесного сосуществования жидкой и паровой фаз, причем при приближении к кривой KF содержание жидкости уменьшается, а пара возрастает. В технике смесь кипящей жидкости и сухого пара называют влажным паром.
- область III — область перегретого пара.
Изотерма BF, разграничивающая области IV и V и VI и V, определяет температуру равновесного сосуществования всех трех фаз, т. е. тройную точку вещества (для воды в точке А s0 = 0 Дж /(кг∙ К), p0 = 611Па, T0 = 273.16 K, v0 = 0.00100 м3 / кг). Линия AKF представляет пограничную кривую между жидкой и паровой фазой. Точка К этой кривой есть критическая точка. Ветвь АК пограничной кривой, называемая также левой пограничной кривой, есть линия кипящей или насыщенной, т. е. находящейся в равновесии с насыщенным паром, жидкости; ветвь KF или правая пограничная кривая есть линия сухого насыщенного пара.
Через точку К проходит изотерма, на границе которой происходит переход непосредственно из жидкости в перегретый пар. При температуре и давлении выше критических вещество может находиться только в жидком или газообразном (сухой перегретый пар) состоянии.
В таблице приведены критические параметры для некоторых технических газов, а также так называемый критический коэффициент, представляющий собой отношение
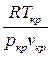 ,
,
который был бы равен 1,0, если бы реальные газы в критической точке следовали законам идеальных газов. На самом деле, как видно из таблицы, критический коэффициент для газов в три с лишним раза больше единицы, а для водяного пара примерно в 4,5 раза больше.
Таблица 8
| Газ | ркр, МПа | tкр, 0C | Критический коэффициент 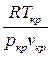 |
| Гелий Не Водород Н2... Азот N2..... Окись углерода СО Кислород О2.., Углекислота СО2 Водяной пар Н2О | 0,222 1,255 3,285 3,40 4,99 7,16 22,129 | —267,8 —239,9 —147,1 —139 —118,8 +31,35 +374,15 | 3,184 3,28 3,42 3,54 3,346 3,49 4,458 |
ВОДЯНОГО ПАРА
Воде в качестве рабочего тела присущ серьёзный недостаток: в пределах рабочих температур она находится в трёх состояниях: жидком, влажного и сухого пара. Из рис. 1а видно, насколько линии изотерм для воды отличаются от изотерм газов.
Для водяного пара отношение
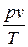
 |
| Рис. 1а. Протекание изотерм при разных состояниях воды |
зависит от параметров пара, в отличие от идеальных газов, где это выражение называется газовой постоянной R и практически не зависит от их давления или температуры. Поэтому к водяному пару не применимо уравнение состояния, как для газов, и расчёт его параметров осуществляется по особым правилам.
Рассмотрим отдельные стадии процесса образования водяного пара.
Получение водяного пара для технических нужд осуществляется в паровых котлах, где при этом поддерживается неизменное давление по манометру в течение всего времени его работы.
На v-p — диаграмме процесс превращения 1 кг воды при р = const в перегретый пар изображается линией a-b-c-d-e, а на v-t — диаграмме—линией а' - b' -с' -d' -e'. Процесс испарения, происходящий за счет теплоты q, подводимой к воде, начинается в точке а, когда в цилиндре находится капельно-жидкая вода при давлении р и температуре 0° С.
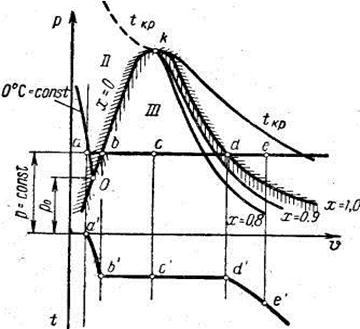 |
| Рис.2. Изображение процесса получения пара в координатах v-p |
Различают несколько стадий в процессе парообразования. Область II. Прежде всего необходимо нагреть воду от 0° С до температуры кипения, величина которой зависит от давления. На процесс нагревания а-b затрачивается определенное количество теплоты. Тепловое расширение воды приводит к тому, что объем воды кипящем состоянии больше, чем при 0° С, и поэтому на v-p — диаграмме точка b лежит правее точки а. На этой стадии вода— гомогенная среда, в которой вещество находится в капельно-жидком, некипящем состоянии.
На v-t — диаграмме процесс нагревания до температуры кипения (или температуры насыщения) изображается линией а'-b'.
Область III. Дальнейший подвод теплоты приводит к испарению воды. Количество пара тем больше, чем больше будет подведено теплоты на этой стадии парообразования. При этом температура воды и пара в процессе испарения остается также, как и давление, постоянной и равной t" до тех пор, пока вся вода не превратится в пар (точки d и d' на рис. 1). В промежуточной точке с и с'- находится смесь кипящей воды и пара. Среда в этой области — гетерогенная, двухфазная, в которой кипящая жидкость и сухой насыщенный пар находятся в равновесии. Характерно, что в области III процессы(например, b-d) являются одновременно как изобарными, так и изотермными. Это иллюстрируется линиями b-d и b'-d' в обеих системах координат. Подведённая теплота на этой стадии расходуется на парообразование. В технике смесь кипящей жидкости и сухого пара называют влажным паром.
Точки, характеризующие влажный пар, на обеих диаграммах расположены между b и d (или соответственно между b' и d'). Состояния между этими точками отличаются друг от друга количествами полученного пара и оставшейся еще не испарённой кипящей воды. Чём ближе точка с к точке d, тем меньше влажность и больше паросодержание.
Точка d на верхней пограничной кривой определяет состояние в момент, когда вся вода превращается в пар, а температура его продолжает оставаться равной t". Состояние это называется сухим насыщенным паром.
Область III. Подвод теплоты к сухому насыщенному пару вызовет его перегрев, т.е. увеличение температуры выше температуры насыщения t". Во всех точках, лежащих правее точки d на линии р = const (например, в точке е), пар является перегретым. В технике состояние газа вблизи от верхней пограничной кривой принято называть перегретым паром. Среда — гомогенная, в которой вещество находится в газообразном состоянии. Разница состояний перегретого пара заключается в различных значениях температур перегрева, которые тем выше, чем дальше вправо от точки d располагается точка е.
Путем изменения в ту или другую сторону величин давления, при которых происходит процесс парообразования, можно на рис. 1 наметить ряд точек a, b, d, a', b', d', соответствующих определенным давлениям. Соединение одноименных точек между собой плавной кривой дает три кривые.
Совокупность геометрических мест точек а дает изотерму капельно-жидкой воды при температуре 0° С. Изотерма капельно-жидкой воды при температуре 0° С с увеличением давления очень медленно из-за малой сжимаемости воды приближается к оси ординат, а в точке О пересекает линию кипящей жидкости.
Совокупность геометрических мест точек b дает кривую состояний кипящей воды при определенных давлениях нижней пограничной кривой.
Совокупность геометрических мест точек d дает кривую_сухого насыщенного пара также при определенных давлениях верхней пограничной кривой.
С повышением давления точки bсd приближаются друг к другу и при определенных давлении и объеме встречаются в критической точке К. Для воды параметры критической точки к составляют: ркр = 221,29 бар, укр = 0,00326 м3/кг; tкр = 374,15° С. На рис.2 нанесена изотерма при tкр , выше которой происходит непосредственный переход от жидкости к перегретому пару.
 2014-02-09
2014-02-09 2363
2363
