Метод исследования процессов, не зависящий от их особенностей и являющийся общим, состоит в следующем:
- выводится уравнение процесса, устанавливающее связь между начальными и конечными параметрами рабочего тела в данном процессе;
- вычисляется работа расширения и располагаемая (техническая) работа газа;
- определяется количество теплоты, подведенной (или отведенной) к газу в процессе;
- определяется теплоёмкость процесса;
- определяется изменение внутренней энергии системы в процессе;
- определяется изменение энтальпии системы в процессе.
- определяется изменение энтропии системы в процессе.
Изохорный процесс (закон Шарля). Закон открыт экспериментальным путём французским физиком Жаком Шарлем (1746-1823) в 1787 году.
При изохорном процессе выполняется условие v = const и dv = 0.
Из уравнений состояния идеального газа, составленных для точки 1 и точки 2
р1v1/p2v2 = T1/T2
следует, что давление газа в изохорном процессе (v1 = v2 сокращаются) прямо пропорционально его абсолютной температуре
р2 / р1 = Т2/Т1. (2)
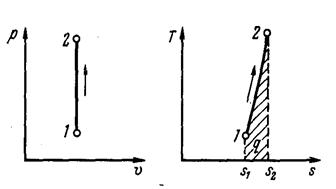 |
| Рис. 3. Изображение изохорного процесса в р, v- и Т, s - координатах |
На рис. 3 представлен график процесса.
Работа расширения pdv в этом процессе равна нулю, так как dv = 0
l = 0.
Располагаемая работа
p2
lpacп = -v ∫dp = v(p1 - p2 ).
p1
Количество теплоты, подведенной к рабочему телу в процессе 1- 2 при
теплоёмкости процесса сv = const, определяется из уравнения 1-го закона термодинамики
δq= du+ δl:
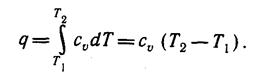 (3)
(3)
При переменной теплоемкости сv = var
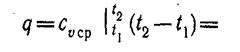
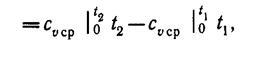 (4)
(4)
где 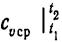 — средняя массовая изохорная теплоемкость в интервале температур от t1 до t2.
— средняя массовая изохорная теплоемкость в интервале температур от t1 до t2.
Внутренняя энергия. Так как l = 0, то в соответствии с первым законом термодинамики Δ u = q и
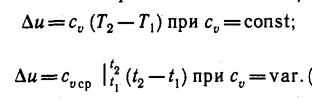
(5)
Поскольку внутренняя энергия идеального газа является функцией только его температуры, то формулы (5) справедливы для любого термодинамического процесса идеального газа.
Изменение энтальпии
Δi = cp (Т2 – Т1).
Изменение энтропии в изохорном процессе определяется из ранее полученной общей формулы:
s2 – s1 = 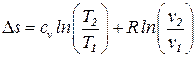 .
.
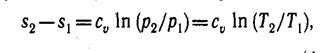
(6)
т. е. зависимость энтропии от температуры на изохоре при сv = const имеет логарифмический характер (см. рис. 3).
Об авторстве существуют противоречивые мнения.
1. Впервые гипотеза о пропорциональности давления и температуры была высказана в 1702 году французским физиком Гильомом Амонтоном. Однако точная формула соответствующего закона была получена лишь через сто лет французским учёным Ж. Л. Гей-Люссаком. В отечественной литературе этот закон иногда ошибочно называют законом Шарля. На самом деле французский учёный Шарль никакого отношения к этому закону не имеет. Закон о пропорциональности давления и температуры носит название Гей-Люссака.
2. Закон был открыт в 1787 году французским физиком Жаком Шарлем. Однако результаты своих экспериментов Шарль не опубликовал. Через 15 лет к тому же выводу независимо от Шарля пришли английский учёный Джон Дальтон и французский физик Жозев Луи Гей-Люссак. В отличие от Дальтона, Гей-Люссак сформулировал свой вывод более определённо, и притом в количественной форме. Поэтому новый газовый закон стали называть законом Гей-Люссака. Однако сам Гей-Люссак с благородством, которое редко можно встретить в вопросах приоритета, настоял на том, чтобы этот закон назвали в честь Шарля. С тех пор в западной литературе третий газовый закон называют законом Шарля.
ШАРЛЬ (Charles), Жак Александр Сезар
 |
12 ноября 1746 г. – 7 апреля 1823 г.
Закон давления, описанный выше, должен быть на самом деле приписан Гильому Амонтону, который в конце XVII века (точнее между 1700 и 1702 годом) обнаружил, что давление фиксированной массы газа, поддерживаемого при постоянном объёме, пропорционально его температуре. Амонтон обнаружил это при постройке «воздушного термометра».
Закон Шарля был известен как закон Шарля и Гей-Люссака, поскольку Гей-Люссак опубликовал его в 1802 году с использованием по большей части неопубликованных с 1787 года данных Шарля. Однако называть этот закон законом Гей-Люссака просто некорректно, поскольку Гей-Люссак исследовал взаимосвязь между объёмом и температурой, а не давлением и температурой.
Закон Гей-Люссака, закон Шарля и закон Бойля — Мариотта все вместе образуют объединённый газовый закон. В сочетании с законом Авогадро эти три газовых закона обобщаются до уравнения состояния идеального газа.
Жак Александр Сезар Шарль – французский физик, математик и изобретатель. Член Парижской Академии наук (с 1795), её президент (1816). Родился в Божанси. Образование получил самостоятельно. В молодости переехал в Париж, где был канцелярским служащим в министерстве финансов. После 1795 г. – профессор экспериментальной физики в Консерватории искусств и ремесел в Париже.
Исследовал расширение газов, установил (1787) закон изменения давления данной массы идеального газа с изменением температуры при постоянном объеме (закон Шарля).
Сразу же после братьев Жозефа-Мишеля и Жака-Этьенна Монгольфье построил (1783) воздушный шар из прорезиненной ткани, наполненный водородом; осуществил полет на этом шаре. Воздушный шар такого типа получил по имени изобретателя название шарльер, в противоположность монгольфьеру. Изобрел ряд приборов. Первый предпринял попытку получения фотографических изображений.
Известен также как талантливый математик. Впервые показал, что функцию, определенную двумя или большим числом законов, например ломаную, составленную из двух отрезков прямых, можно всегда выразить одним общим законом (1785). Распространил на разностные уравнения понятие особого интеграла.
Изобарный процесс (закон Гей Люссака, 1802 г.) (Гей Люссак – французский химик и физик, 1778-1850).
При изобарном процессе выполняется условие р = constи dр = 0.
Определим взаимосвязь между параметрами рабочего тела (p,v,T) и параметрами процесса(q, l, u, i, s).
Из уравнений состояния идеального газа, составленных для точки 1 и точки 2 следует, что отношение объёмов равно отношению температур:
v1 / v2 = T1 / T2.
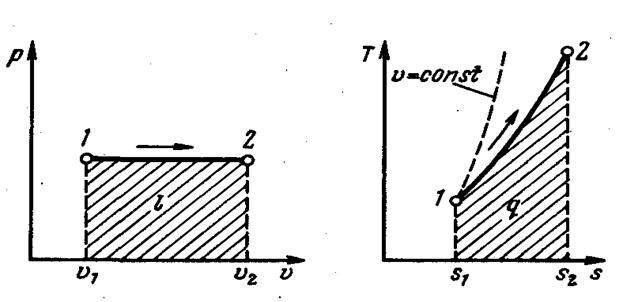 |
| Рис. 4.2. Изображение изобарного процесса в р, v- и Т, s-координатах |
Теплота процесса, т.е. количество теплоты, сообщаемое газу при нагревании (или отдаваемое им при охлаждении), находим из уравнения:
q = cp (T2-T1),
где ср – либо постоянная, либо средняя теплоёмкость при постоянном давлении в интервале температур от t1 до t2.
Изобарный процесс удобно изображать в р, v - координатах, где он проходит в виде горизонтальной линии.
Работа расширения (внешняя работа), определяемая путём интегрирования выражения pdv, равна
l = p (v2 – v1).
Располагаемая работа dlрасп = vdp, так как dр = 0, равна нулю.
Изменение внутренней энергии
Δu = cv (Т2 – Т1).
.
Изменение энтальпии
Δi = cp (Т2 – Т1).
Изменение энтропии
Δs = cp ln (T2 / T1).
Температурная зависимость энтропии при изобарном процессе так же, как и при изохорном, имеет логарифмический характер, но поскольку cp > cv, то изобара на Т, s-диаграмме протекает положе, чем изохора.
 |
 2014-02-09
2014-02-09 4384
4384
