Травмы
Гей-Люссак обладал прекрасным здоровьем, однако страдал от последствий травм, полученных при проведении химических опытов. 3 июня 1808 года он получил ожоги обоих глаз в результате взрыва во время опытов с калием. В течение года Гей-Люссак не мог переносить яркого света, и до конца жизни, по выражению его жены, «его глаза оставались слабыми и красными».
В последние годы жизни Гей-Люссак получил серьёзную травму руки в результате взрыва стеклянного сосуда с газообразными углеводородами. Некоторые врачи считали эту травму причиной его смерти, которая последовала через несколько лет.
- Великий химик и учитель Гей-Люссака Бертолле, умерший в 1822 году, завещал своему ученику шпагу пэра Франции, так как не сомневался, что со временем Гей-Люссак войдёт в палату пэров. Тем не менее избрание Гей-Люссака затянулось на долгие годы, поскольку по тогдашним представлением пэру Франции не подобало заниматься ручным трудом.
- Открытие Гей-Люссаком газовых законов послужило импульсом для Амадео Авогадро к проведению активных экспериментов, что в конечном счёте привело к открытию Числа Авогадро.
Гей-Люссак (Louis Joseph Gay-Lussac) — знаменитый фр. хим. и физик; родился 6 декабря 1778 г. в городке Сен-Леонар (Saint-Leonard) в дпт. верхней Виенны. Отец Г.-Люссака был медик, дед — королевский прокурор. Юношеские годы Г.-Люссака, совпавшие со временем Революции, прошли при крайне стесненных обстоятельствах. Отец его, внесенный в список «подозрительных» и заключенный в тюрьму, преждевременно скончался, а пансион., в котором воспитывался молодой Г.-Люссак (некоей г-жи Сенсы, в Посси), дошел до полной нищеты. Под конец в пансионе остался один Г.-Люссак, за которого семья платила небольшим количеством муки. Сопровождая свою воспитательницу по ночам в Париж для продажи молока, Г.-Люссак на обратном пути днем, лежа в тележке, изучал геометрию и алгебру и готовился таким образом к поступлению в Политехническую школу. Выдающиеся способности, необыкновенная усидчивость и крепкий организм победили все препятствия, и Г.-Люссак блестяще выдержал вступительный экзамен. Будучи учеником Политехн. школы, Г.-Люссак обратил на себя внимание знаменитого Бертолле, взявшего его помощником для лабораторных работ. Хотя результаты исследований Г.-Люссака оказались диаметрально противоположны предположениям Бертолле, прямота молодого исследователя окончательно расположила в его пользу Бертолле: «Молодой человек», сказал ему Бертолле, «вы предназначены сделать открытия, я желаю быть вашим отцом в науке и убежден, что этот титул некогда составит мою славу». С того времени жизнь Г.-Люссака представляет непрерывное движение по пути к высшей славе ученого и к высшему общественному положению. В 1808 г. Г.-Люссак был проф. физики в Сорбонне и с 1809 г. проф. химии в Политехнической школе до 1832 г., когда он принял профессуру общей химии в Jardin des Plantes. С 1830 г. он был членом палаты депутатов, а с 1839 г. пэром Франции. Сверх того, Г.-Люссак занимал должность пробирера в Bureau de Garantie и, в качестве члена правительственных комиссий, привел к решению многие важные технические вопросы. Умер в 1850 г.
Научная деятельность Г.-Люссака поражает своею обширностью и разносторонностью. В физике, химии минеральной, органической и техн. Г. оставил капитальнейшие исследования. Он находил простые соотношения и точные результаты там, где многим это не удавалось. Величайшую важность представляет открытый им закон простых отношений объемов химического соединения и составных частей в газообразном состоянии. Исследования над расширением газов от теплоты, над плотностью паров (для чего он впервые построил соответствующие аппараты), над теплоемкостью газов, над расширением жидкостей, над капиллярным поднятием (построил впервые катетометр), над испарением и распространением паров в газах, магнитные наблюдения — составили Г.-Люссаку славу замечательного физика. Классическим образчиком хим. исследования в обл. минеральной химии является и поныне исследование йода и его соединений, впервые Г.-Люссаком произведенное. Г.-Люссак произвел также обширный ряд исследований соединений хлора (впервые выделил хлорную кислоту), кислородных соединений серы (впервые получил вместе с Вельтером дитионовую кислоту), сернистого водорода, серной печени, кислородных соединений азота. Вместе с Тейлором изучая хим. действия сильной батареи, Г.-Люссак нашел способ получать щелочные металлы в значительных количествах. Благодаря этому способу, авторы могли испытать действие калия и натрия на множество веществ и впервые получили бор. В области соединений углерода работы Г.-Л. открывают новый метод их изучения. Он открыл циан (синерод, азотистый углерод), получил впервые чистую синильную кислоту, определил ее состав и, исследовав многие соединения синерода, раскрыл их истинную природу. Эти исследования впервые дали образчик сложной группы (CN), сходной с простыми телами (галоидами), образующей своеобразный ряд соединений и способной существовать отдельно. Отсюда родилось понятие о радикале (сложной группе), которое составляет основано современного учения о строении углеродистых соединений. Работы над образованием эфиров, над брожением, над исследованием серновинной кислоты, винной кислоты и другие увеличили запас сведений об этих предметах. Вместе с Либихом Г.-Л. открыл гремучую кислоту, получившую впоследствии такое важное значение в пиротехнике. Эта же работа послужила поводом к усовершенствованию анализа органических соединений. Но особенное значение в вопросе о составе органических соединений имел открытый Г.-Л. закон объемных отношений в газообразном состоянии. Г.-Л. показал, как можно контролировать данные анализа, опираясь на этот закон и зная плотность пара исследуемого соединения. Чрезвычайно важные услуги оказал Г.-Л. технике усовершенствованием в фабрикации серной кислоты, исследованием селитры и пороха, особенно же изобретением простых и точных аналитических методов для определения достоинства сырых материалов и продуктов техники. Благодаря введенной им колонне (башня Г.-Л.), фабрикация серной кислоты сделалась гораздо экономичнее и заводы серной кислоты перестали отравлять воздух вредными газами. Г.-Л. придумал методы алкалиметрии, ацидиметрии и хлорометрии. Его объемный способ определения серебра и теперь применяется во всех монетных дворах. Работы его дали могучий толчок химии, возбудив интерес к отысканию точных количественных отношений, управляющих химическими явлениями. Труды Г.-Л. помещены большею частью в «Annales de chimie et de physique», которые он с 1815 по 1850 г. издавал в сообществе с Араго.
По своему характеру Г.-Л. представлял необыкновенно цельную и законченную натуру. Искренность, прямота, необыкновенная настойчивость в достижении раз намеченной цели — вот выдающиеся черты характера Г.-Л. Строгий к другим и к самому себе, Г.-Л. подкупал своею прямотою и своих противников. Случайная встреча его с Гумбольдтом произошла вскоре после резкой критики Г.-Л. (тогда еще начинающего ученого) эвдиометрических исследований Гумбольдта. Несмотря на это, после короткого разговора с Г.-Л., Гумбольдт предложил ему свою дружбу и вскоре оба ученые произвели совместно знаменитую эвдиометрическую работу, в кот. дан был первый образчик простых отношений в газообразном состояли для случая образования воды. По поводу своего участия в этой работе Гумбольдт заявил, что они работали вместе, но теоретический смысл полученных результатов раскрыть был исключительно проницательностью Г.-Л. Они совершили продолжительное научное путешествие с научной целью по Европе и дружеские их отношения не прерывались до конца. Замечателен поступок Г.-Л. по отношению к одному из профессоров Политехн. школы, которому угрожала потеря профессуры за подпись в пользу Наполеона во время Ста дней. Г.-Л. открыто заявил, что в таком случае должны начать с него, ибо он подписал тот же акт; товарищ был спасен. В работе Гей-Люссак не щадил себя. Первый раз работая с большими количествами калия (в 1809). Г. так сильно поранил глаза, что почти год мог выносить только свет ночника и всю жизнь его глаза оставались красными и слабыми. Настойчивость и замечательную смелость обнаружил Г.-Л. своими воздушными путешествиями. Первый раз он поднялся на аэростате вместе с Био в 1804 г. Малые размеры шара не позволили молодым ученым подняться выше 4000 метр., а вращение шара мешало произвести магнитные наблюдения. Поэтому Г.-Л. решился вскоре подняться один, достиг высоты 7016 метр.,. произвел ряд важных наблюдений над температурой и влажностью воздуха, над колебаниями магнитной стрелки, и благополучно спустился, сохранив пробы воздуха с высоты 6600 метр. Всегда серьезный и сдержанный, Г.-Л. был способен к порывам искренней веселости. Ученики видели его не раз в лаборатории пляшущим в калошах (лаборатория помещалась в подвале) после удачного опыта. Г.-Л. был чужд политических партий; в палате депутатов и в палате пэров он выступал на кафедре только тогда, когда затрагивались вопросы, связанные с научными исследованиями.
Изотермный процесс (закон Бойля и Мариотта, 1662 г.)
(английский физик и химик Роберт Бойль, 1627-1691 в1662 году и независимо французский физик Эдм Мариотт, 1620-1684 в1676 году).
При изотермном (изотермическом) процессе выполняется условие Т = constи dТ = 0.
Посколько при изотермическом процессе температура постоянна, то, в уравнениях состояния для точек 1 и 2 T сокращается и
p2 / p1 = v1 / v2.
т. е. давление и объем при изотермическом процессе обратно пропорциональны друг другу.
Графиком в р, v -координатах, как показывает полученное уравнение, является равнобокая гипербола, для которой координатные оси служат асимптотами (рис. 4.3).
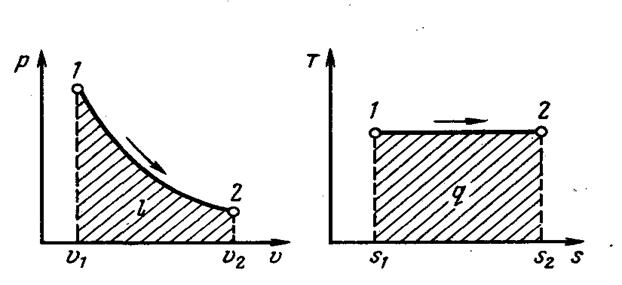 |
| Рис. 4.3. Изображение изотермического процесса в р, v- и Т, s-координатах |
При изотермном процессе теплота процесса равна внешней и располагаемой работам,:
q = l = lpасп = RT ln (v2 / v1).
Так как температура постоянна, то теплоёмкость изотермного процесса
сТ = dq / dT = ∞,
а изменение внутренней энергии и энтальпии равно
Δu = Δi = 0.
Изотермный процесс, также как и изобарный процесс в p, v – координатах, в T, s – координатах проходит в виде горизонтальной линии.
Изменение энтропии
Δs = q /Т = R ln (v2 / v1).
В Англии этот закон называют законом Бойля, во Франции – законом Мариотта, а у нас – законом Бойля – Мариотта. Открыт он был экспериментальным путём задолго до создания статистической термодинамики. Впервые гипотеза о постоянстве произведения рV была высказана в 1661 году английским любителем физики Р. Тоунли. В том же году опыты по проверке этой гипотезы были проведены лордом Броункером и врачом Генри Пауэром. Однако в наиболее широких пределах эта гипотеза была подтверждена приблизительно в это же время экспериментами английского физика Роберта Бойля. Он первым опубликовал свои результаты (1662), причём по полноте и точности они намного превосходили данные других исследователей, среди которых был и Роберт Гук, который, по свидетельству самого Бойля, уже в 1660 году располагал данными, согласующимися с гипотезой Тоунли.
Английский химик и физик Роберт Бойль (1627— 1691) родился и провел свое детство в замке Лисмор (Ирландия), в семье герцога Корского — богатого и удачливого авантюриста. Он закончил известный колледж в Итоне на р. Темзе, совершил путешествие по Италии, Франции, несколько лет учился в Женеве. Как и многие его сверстники (Паскаль, Стено), Бойль попал под влияние религии. Но жизненная линия Бойля этим но определилась. Он вел аскетический образ жизни (может быть, этому содействовало его слабое здоровье), не участвовал в войне (а именно в это время в Англии велась гражданская война, республиканцы во главе с Кромвелем наносили королевской армии одно поражение за другим) — все его интересы были связаны с наукой.
Вернувшись в Англию, Бойль активно участвовал в деятельности так называемой «невидимой коллегии» — некоем прообразе Королевского общества,— обосновавшейся в Оксфорде, но проводившей свои заседания то в Оксфорде, то в Лондоне, за что она и получила свое наименование.
В 1663 г. официально было основано Лондонское королевское общество, одним из главных инициаторов образования которого был Бойль. В 1680 г. Бойль, получивший в 1665 г. степень почетного доктора физики Оксфордского университета и с 1668 г. обосновавшийся в Лондоне, был избран президентом Королевского общества, но отказался от этого поста.
Дж. Бернал пишет: «Бойль. несомненно, представлял гобой центральную фигуру в Королевском обществе начального периода его существования, подобно тому как Ньютон был центральной фигурой в период его расцвета».
Бойль сделал для науки очень много. По своим научным интересам и знаниям Бойль был ученым-энциклопедистом. Бойль положил начало преобразованию химии в самостоятельную науку. Он дал определение элементу вещества как простому телу, которое уже не может быть разделено на другие, более простые тела. Другими словами, химический элемент, по Бойлю, это предел качественного деления вещества. Бойль категорически отвергал господствовавшее со времен Аристотеля утверждение, что огонь якобы является универсальным анализатором тел, что с его помощью (при горении) можно только разделять тела на более простые, но нельзя получать тел более сложного состава.
Бойль считал несостоятельным исходящее еще от Аристотеля утверждение о четырех стихиях (огне, воздухе, воде и земле). Он также не признавал учения Парацельса о трех началах: сере, ртути и соли. В своих исследованиях Бойль использовал методы количественного и качественного анализа, ввел в практику исследований взвешивание.
Одновременно с Мариоттом и независимо от него Бойль, как уже говорилось, открыл газовый закон, известный теперь как закон Бойля—Мариотта.
Французский физик Эдм Мариотт (1620—1684) был разносторонним ученым. Он занимался оптикой, дифракцией света, гидравликой, но более всего известен своими исследованиями свойств газов. В одно время с Р. Бойлем и независимо от него Мариотт установил закон, согласно которому объем газа при постоянной температуре обратно пропорционален его давлению, или произведение удельного объема газа на его давление при неизменной температуре есть величина постоянная, т. е, при t = idem, pv = const, где р — давление газа, v — удельный объем, t — температура. Имя французского аббата Эдма Мариотта в названии закона появилось благодаря его работе “Речь о природе воздуха” (1676), в которой были описаны опыты, аналогичные экспериментам Бойля, и при этом без ссылок на работы последнего. Остается добавить, что Мариотт был одним из первых членов Парижской Академии наук.
 2014-02-09
2014-02-09 3354
3354








