Основное уравнение МКТ идеального газа
Курс лекций
Информационная БЕЗОПАСНОСТЬи защита информации
| Подписано в печать | Формат 60х84 |
| Бумага офсетная | Офсетная печать |
| Печ.л. 4,0 | Заказ № |
| Тираж экз. |
___________________________________________________________________
Отпечатано в типографии КубГАУ, 350044, г. Краснодар, ул. Калинина, 13
Если размеры сосуда, в котором находится газ, меньше средней длины свободного пробега, то столкновения молекул между собой происходят редко. Главным образом молекулы будут сталкиваться со стенками сосуда. В этих обстоятельствах можно считать, что молекулы представляют собой невзаимодействующие частицы. Такую абстрактную модель газа, в определенных обстоятельствах близкую к реальности, называют идеальным газом. Понятно, что применимость данной модели для описания физической ситуации должна зависеть от размеров сосуда, занимаемого газом.
Рассмотрим пример: в лабораторной колбе содержится азот. Оценим объемную концентрацию азота, при которой к нему применима модель идеального газа.
При комнатной температуре и атмосферном давлении концентрация азота в воздухе составляет n0=2×1019см-3. При этой концентрации средняя длина свободного пробега составляет
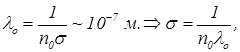 (1)
(1)
где s - сечение рассеяния молекул азота. При оценке средней длины свободного пробега использованы данные одной из задач практического занятия. Чтобы для азота была пригодной модель идеального газа, средняя длина свободного пробега должна быть порядка размера колбы L. При этом
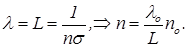 (2)
(2)
Полагая, что L~10 см, из (2) получаем оценку n~10-6n0.
Возможны ситуации, формально не удовлетворяющие условию применимости модели идеального газа, но в которых, тем не менее, применение модели дает хорошее согласие предсказываемых характеристик состояния с опытными данными. В этих случаях можно утверждать, что столкновения молекул между собой не влияют на значения характеристик.
 2014-02-09
2014-02-09 643
643







