Как ранее было показано, средняя кинетическая энергия молекул газа является универсальным термометрическим параметром и связана с температурой по шкале Кельвина соотношением
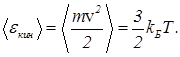 (16)
(16)
Подставим выражение (16) в формулу для давления (13). Тогда получим
P=n kБT. (17)
Уравнение (17) связывает между собой давление, температуру и объемную плотность молекул. Уравнения данного типа называются уравнениями состояния.
Чаще в качестве параметра состояния газа используют не объемную плотность n молекул, а объем V и количество газа. Перейдем от n к переменной V. Учтем, что
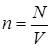 . (18)
. (18)
Полное число молекул N можно представить в виде
N=nN0, (19)
где n – число молей газа в ящике, N0 - число молекул в одном моле (число Авогадро). Таким образом, уравнение (17) принимает вид:
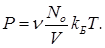 (20)
(20)
Комбинация N0kБ является новой постоянной R, именуемой универсальной газовой постоянной. Если использовать ее, то уравнение (20) записывается так
PV=nRT (21)
Уравнение (21) хорошо известно как уравнение Клапейрона-Менделеева, связывающее между собой макроскопические параметры состояния идеального газа P, V, T.
Как показывают экспериментальные данные, уравнение (21) с высокой точностью описывает состояние реального газа далеко за пределами применимости модели идеального газа. Например, состояние азота, кислорода, водорода, гелия, аргона и многих других газов при атмосферном давлении и температурах, далеких от температуры конденсации, при любом размере сосуда вполне удовлетворительно описывается уравнением Клапейрона-Менделеева.
 2014-02-09
2014-02-09 526
526








