Технологические характеристики твердых катализаторов
Общие представления о катализе
ПЛАН ЛЕКЦИИ
Лекция 9
В качестве кинетических моделей газожидкостных реакций используют пленочную модель и модели обновления поверхности
ВЫВОДЫ
1.Лимитирующую стадию гетерогенного процесса определяют методами основанными на:
- изучении параметров процесса на его скорость
-сравнении экспериментальных и теоретических зависимостей
• Катализаторы — это вещества, которые вступают в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции.
• Они восстанавливают химический состав после каждого цикла промежуточных взаимодействий.
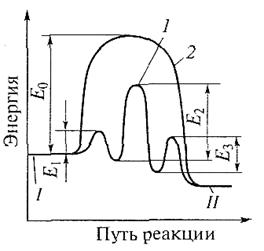
В присутствии катализатора реакция протекает по энергетически более выгодному пути, в результате чего скорость процесса увеличивается катализатор не изменяет состояние химического равновесия, которое не зависит от пути.
Исходное (/) и конечное (У7) энергетические состояния реакционной системы в присутствии катализатора и без него остаются одинаковыми.
Следовательно, катализатор не может изменить состояние химического равновесия, которое не зависит от пути
Роль катализатора состоит в изменении скорости состояния равновесия.
Катализатор может увеличивать скорость только тех процессов, которые разрешены термодинамически, но не может инициировать реакции, протекание которых невозможно при данных условиях в соответствии с законами химической термодинамики.
Некоторые химические реакции без катализаторов практически неосуществимы, например, из-за слишком большой энергии активации. Казалось бы, что для преодоления высокого энергетического барьера можно повысить кинетическую энергию молекул, т. е. увеличить температуру. Но для многих обратимых экзотермических реакций повышение температуры приводит к равновесия в обратную сторону и делает реакцию термодинамически. В таких случаях применение катализатора не только оправдано, но и необходимо. Катализатор снижает энергию активации реакции и позволяет тем самым проводить ее при существенно более низких температурах.
Активность катализатора — мера ускоряющего воздействия по отношению к данной реакции.
Количественным критерием активности катализатора для данной реакции служит константа скорости, измеренная для разных катализаторов в сопоставимых условиях.

Применение катализатора приводит к изменению порядка реакции, энергии активации и величины предэкспоненциального множителя.
Если каталитическая реакция имеет такой же порядок, что и некаталитическая, активность катализатора А можно определить, как отношение констант
 |
Чрезвычайно важна роль катализаторов в осуществлении сложных реакций, так как катализаторы обладают способностью избирательно влиять на скорость только какой-то одной нужной реакции. Так, например, сейчас трудно представить процесс крекинга нефтепродуктов (система сложных последовательных и параллельных реакций) без селективно действующих цеолитных катализаторов, позволяющих направить процесс в сторону получения высококачественного бензина.
Каталитические процессы подразделяют на две большие группы: гомогенные и гетерогенные. Наибольшее распространение в промышленности получили гетерогенно-каталипшческие процессы. В свою очередь, при протекании подавляющего большинства гетерогенно-каталитических процессов границей раздела фаз служит поверхность твердого катализатора, находящегося в газообразной или жидкой реакционной среде. Существенным преимуществом таких процессов является простота разделения продуктов реакции и частиц катализатора для повторного использования катализатора.
 2014-02-09
2014-02-09 1226
1226








