Прогнозирование свойств элементов по положению в периодической таблице
Кислотно-основные свойства элементов и образуемых ими оксидов и гидроксидов
Электроотрицательность и окислительно-восстановительные свойства элементов
Энергия сродства к электрону
Энергия ионизации
В периодах радиусы атомов по мере увеличения заряда ядра уменьшаются вследствие увеличения электростатического взаимодействия электронов с ядром.
В главных подгруппах радиусы увеличиваются в связи с увеличением количества энергетических уровней.
В побочных подгруппах в соответствие с заполнение d- и f-подуровней происходит увеличение электростатического притяжения электронов к ядру, в результате чего радиусы атомов не только не увеличиваются, но даже могут уменьшаться. Данное явление называют d- и f (лантаноидным)- сжатием.
Энергия ионизации атома – это количество энергии, необходимое для отрыва электрона от атома. Вторая и последующие энергии ионизации – это отрыв электронов от положительно заряженных ионов. Энергия ионизации определяет восстановительные свойства элементов. В периодах энергия ионизации растет. В главных подгруппах – уменьшаются, а в побочных подгруппах – увеличивается.
Энергия сродства к электрону – это количество энергии выделяющаяся или поглощающаяся при присоединении электрона к нейтральному атому. Чем больше энергия сродства атома к электрону, тем более сильным окислителем является данный элемент. В периодах энергия сродства к электрону возрастает, а в главных подгруппах для неметаллов уменьшается. Металлы не обладают сродством к электрону.
Электроотрицательность – способности атомов в соединениях притягивать и отдавать электроны.
При движении от наименее электоотрицательного элемента – Fr к наиболее электроотрицательному элементу – F электроотрицательность последовательно нарастает, таким же образом изменяются окислительные свойства элементов.
В периодах основные свойства падают, а кислотные нарастают, а в главных подгруппах наблюдается обратная зависимость. В таблице 3 приведены в общем виде формулы высших оксидов и соответствующих им гидроксидов элементов главных и побочных подгрупп. Из таблицы видно, что в периодах основные свойства падают, а кислотные нарастают, проходя через амфотерные.
Таблица 13. Формулы высших оксидов и гидроксидов элементов III–периода
| Группа | I | II | III | IV | V | VI | VII | VIII (кроме инертных газов) |
| Высший оксид | Na2O | MgО | Al2О3 | SiО2 | P2О5 | SО3 | Cl2О7 | ЭО4 |
| Гидроксид высшего оксида | Na ОН | Mg(ОН)2 | Al (ОН)3 Н Al О2 | Н2SiО3 | Н3РО4 | Н2SО4 | Н Cl О4 | Н4ЭО4 |
Так как в периодической таблице в периодах и группах свойства элементов закономерно изменяются, свойства любого элемента близки к среднеарифметическому значениям свойств элементов между которыми расположен анализируемый элемент. Следует отметить, что Д.И. Менделеев обратил внимание на диагональное сходство элементов. Например, Ве и Аl, В и Si и т.д.
«Химическая связь, строение молекул и строение вещества»
После изучения и разработки теоретических основ строения атома, следующим этапом в изучении строения вещества стало исследование природы химической связи, так как без этого нельзя было объяснить и спрогнозировать состав и строение молекул – частиц включающих два и более атомов.
1. СТРОЕНИЕ МОЛЕКУЛЫ ВОДОРОДА
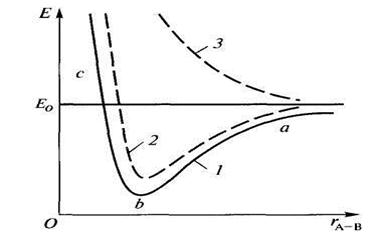 В 1927 г. Гайтлер и Лондон выполнили квантово-механический расчет образования молекулы водорода. Результаты этого расчета приведены на рисунках 1 и 2.
В 1927 г. Гайтлер и Лондон выполнили квантово-механический расчет образования молекулы водорода. Результаты этого расчета приведены на рисунках 1 и 2.

|
|
Из рисунка 1 следует, что по мере сближения атомов с параллельными спинами (кривая 3) энергия системы резко возрастает, то есть химическая связь не образуется. Если спины атомов антипараллельны (противоположны по знаку), то с уменьшением расстояния между атомами энергия системы вначале уменьшается, проходя через некий минимум (участок a-b), а затем увеличивается (участок b-c). Следовательно, образование химической связи возможно, если спины атомов антипараллельны.
Из рисунка 2 видно, что расстояние между центрами атомов в молекуле меньше суммы радиусов двух атомов, то есть происходит взаимное перекрытие электронных облаков. Область перекрытия имеет избыточный отрицательный заряд и электростатически притягивается к ядрам атомов, что обеспечивает между ними химическую связь. Расчет энергии системы из трех атомов водорода не приводит к уменьшению энергии, то есть химическая связь является двухэлектронной и имеет электрическую природу. Расчеты Гайтлера и Лондона положили начало квантовомеханическим методам описания химической связи. Наиболее часто применяются метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
В последующем материале будет применяться только метод валентных связей.
 2014-02-09
2014-02-09 713
713








