Ковалентная химическая связь является двухэлектронной. Электроны, участвующие в образовании химической связи, имеют противоположные спины и образуют общую электронную пару.
Различают обменный и донорно-акцепторный механизмы образования химической связи:
1) Обменный – два атома предоставляют по одному электрону на образование общей электронной пары.
Например, образование молекул водорода и хлороводорода:
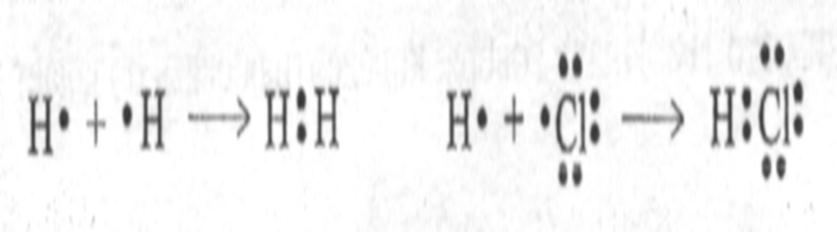
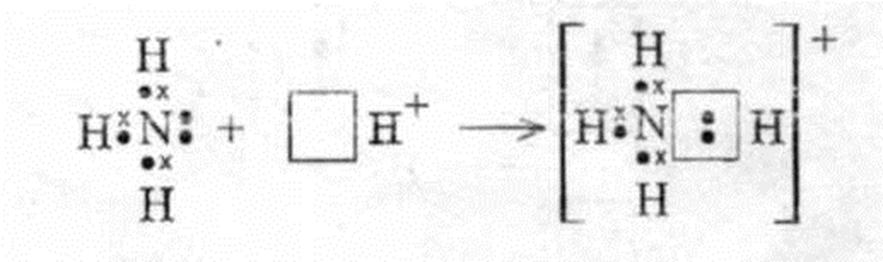
2) Донорно-акцепторный – один атом (донор) предоставляет электронную пару, а второй (акцептор) – свободную орбиталь.
Например, взаимодействие аммиака с ионом водорода с образованием катиона аммония
По способу перекрывания электронных облаков связи делят на σ-связь и π- связь:
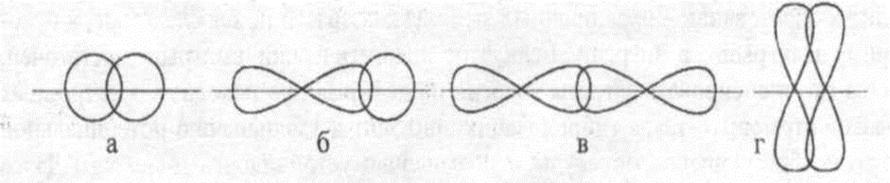
1) σ-связь образуется за счёт перекрывания электронных облаков по прямой линии, соединяющей центры взаимодействующих атомов. Она может осуществляться между двумя s-облаками, двумя p-облаками, s- и p-облаками или между s- и d-облаками.
2) π -связь образуется за счёт перекрывания электронных облаков выше и ниже линии, соединяющей центры взаимодействующих атомов. Она образуется в основном при перекрывании р-орбиталей.
σ-связь является более прочной чем π-связь.
 2014-02-09
2014-02-09 568
568








