Растворимость
Процесс растворения связан с диффузией, т. е. с самопроизвольным распределением частиц одного вещества между частицами другого. При внесении растворяемого вещества в растворитель процесс растворения идет самопроизвольно (DG < 0) и раствор остается ненасыщенным, т. е. в раствор может переходить еще некоторое количество вещества. Когда энтальпийный и энтропийный факторы процесса станут одинаковыми, т. е. DG = 0, система окажется в состоянии истинного равновесия. Раствор становится насыщенным, в такой системе неопределенно долго могут сосуществовать без каких-либо изменений раствор и избыток растворяемого вещества.
При избытке растворяемого вещества одновременно с переходом частиц тв. вещ-ва в раствор происходит обратный процесс – кристаллизация. С течением времени между этими процессами устанавливается подвижное равновесие, при котором в единицу времени растворяется столько вещества, сколько выделяется его из раствора: осадок ↔ растворенное вещество. При равновесии концентрация растворенного вещества не изменяется – это насыщенный раствор, в нем содержится предельное для данной температуры количество растворенного вещества. Концентрация растворенного вещества в насыщенном растворе – мера растворимости в-ва при данных условиях, величина постоянная. Итак, растворимость – концентрация насыщенного раствора при данной температуре.
Можно получить и пересыщенный раствор, т. е. такой, концентрация вещества в котором выше концентрации вещества в насыщенном растворе (при данных температуре и давлении). Пересыщенные растворы можно приготовить осторожным и медленным охлаждением насыщенных при высокой температуре растворов, напр. солей Na2S2O3 CH3COONa. Пересыщенный раствор – системы, находящаяся в кажущемся равновесии DG>0. Встряхивание или внесение в него кристаллов того же вещества вызывает кристаллизацию – система переходит в состояние истинного равновесия.
Растворимость – концентрация в насыщенном растворе.
Растворимость определяется тремя факторами:
1) природа вещества
2) агрегатное состояние
3) внешние условия (Т,р)
Растворимость м.б. ограниченная – вода –эфир, Pb-Zn (ж), LiCl–KCl(ж) и неограниченная спирт-вода, отсутствие растворимости.
Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними. Поэтому газы смешиваются в любых соотношениях. Газовые смеси описываются законом Дальтона:
Общее давление газовой смеси равно сумме парциальных давлений всех входящих в неё газов.
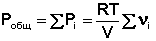
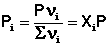
 2014-02-09
2014-02-09 1493
1493
