m0МеmAn = m(m0Ме+RTlnaMe)+n(m0A+RTlnaA), (10.1)
где m0МеmAn,m0Ме, m0A – стандартные химические потенциалы твердой соли и ионов в растворе;
аМе и аА – активности ионов (для упрощения записи заряды ионов
Ме n+ и А m- опущены).
В левой части уравнения (2.1) логарифмический член отсутствует, так как активность твердой фазы принимается равной единице.
Из уравнения (1) следует:
amМе·аnА=exp[(m0МеmAn-mm0Ме-nm0A)/RT]. (10.2)
При данной температуре правая часть уравнения – величина постоянная, отсюда:
аmMe· anA = L (10.3)
или
[Me]m [A]n gmMe gnA=L, (10.4)
где [Me] и [A] – концентрации ионов;
gMe и gA – коэффициенты активности.
Так как в разбавленном растворе (соль малорастворима) gMe = gA» 1, то:
[Me]m [A]n» L. (10.5)
если
[Me] m [A] n < L, (10.6)
то будет происходить растворение твердой соли, а при:
[Me]m [A]n > L (10.7)
будет происходить осаждение соли до установления равновесия.
Для малорастворимых солей произведения растворимости выражаются очень малыми числами, поэтому часто их заменяют показателем:
p L = - lg L. (10.8)
Следовательно:
pL = - lg L = - m lg [Me] - n lg [A]. (10.9)
Если растворимость соли MemAn обозначить S, то концентрации ионов [Me] и [A] равны mS и nS. Отсюда:
L = [Me]m [A]n = (mS) m (nS) n; (10.10)
S m+n = L / (m m n n) или S = 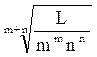 . (10.11)
. (10.11)
Влияние избытка одного из ионов на растворимость соли непосредственно вытекает из выражения для произведения растворимости. Если избыточная концентрация иона значительно превосходит концентрацию его, обусловленную растворимостью соли, то последней можно пренебречь.
Если избыточная концентрация иона Me+ равна CMe+, причем CMe+ >> mS. Тогда:
L = (CMe+ + mS)m(nS)n» CMe+m (nS)n; (10.12)
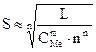 . (10.13)
. (10.13)
Знание L позволяет установить условия для протекания реакций выщелачивания и осаждения труднорастворимых соединений. Из 10.12 следует, что равновесная концентрация Me для двухвалентного соединения может быть определена исходя из следующих рассуждений.
L = СМе2+·СА2- = Сonst.
Отсюда, СМе2+ = L/СА2-.
Значит, чтобы перевести металл в раствор, повысить его концентрацию в растворе, необходимо повысить концентрацию аниона в растворе.
Методы расчета изобарного потенциала и константы равновесия
В металлургических расчетах наибольшее значение имеет определение изобарного потенциала, так как чаще всего металлургические процессы протекают при давлениях, мало отличающихся от атмосферного и которые принимаются неизменными.
Расчет величины изобарного потенциала проводится:
1. По константе равновесия реакции.
ΔZ связано с константой равновесия уравнением,
ΔZ = - RTlnK, (10.14)
R - универсальная газовая постоянная, равная =8.314472 Дж.
Т —температура, К, при которой проводилось определение
константы равновесия реакции;
К — константа равновесия реакции.
Определив опытным путем константу равновесия реакции при температуре Т, затем рассчитывают изменение изобарного потенциала реакции при данной температуре.
2. По изменению электродвижущей силы в обратимом гальваническом элементе по уравнению
ΔZ = - nEF, (10.15)
где п — число химических эквивалентов, участвующих в реакции;
Е — электродвижущая сила элемента;
F — постоянная Фарадея.
3. По уравнению
ΔZ = ΔН - ТΔS, (10.16)
где ΔН — изменение теплосодержания реакции;
ΔS —энтропия реакции (разность суммы энтропии продуктов реакции и исходных веществ, вступивших в реакцию).
4. Путем комбинирования уравнений химических реакций,
для которых известны ΔZ.
Для некоторых веществ значения свободных энергий даны в различных справочных руководствах. Обычно значения ΔZ приведены к стандартным условиям:.комнатной температуре (18, 20 или 25 °С) и давлению в 1 атм.
Расчет констант равновесия реакций, сопровождающихся образованием малорастворимого твердого продукта.
При вычислении константы равновесия реакции по справочным данным DGо298, D Hо298 и DSо298, необходимо помнить, что погрешность в определении последних обычно довольно велика (порядка 10 – 15 кДж/моль для DG и DH). Это ведет к большой относительной ошибке расчетов при малых значениях DGо реакции. Поэтому, если DGо или DНо исходных веществ и продуктов имеют большую абсолютную величину, а их разность (DGо или DНо реакции) не превышает нескольких килоджоулей на моль, результаты расчетов нельзя считать достоверными. В подобных случаях приходится искать другие способы расчета Кр, исходя из сущности процесса.
В случае реакций, сопровождающихся образованием нерастворимого продукта, условием равновесия реакции можно считать отсутствие растворения или осаждения из раствора твердых веществ - исходного или продукта реакции. Это условие выполняется, если произведения активностей в растворе ионов, на которые диссоциируют малорастворимые соединения, равны произведениям растворимости этих соединений. Для подобных реакций Кр можно определить, зная произведения растворимости исходного и образующегося малорастворимых соединений: Кр = Lисх/Lпрод.
В качестве примера рассмотрим определение константы равновесия реакции:
3СаWO4тв+2Na3PO4раств 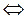 Ca3(PO4)2тв+3Na2WO4раств (10.17)
Ca3(PO4)2тв+3Na2WO4раств (10.17)
которую можно записать в ионной форме:
3СаWO4тв+2PO43-раств 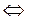 Ca3(PO4)2тв+3WO42-раств (10.18)
Ca3(PO4)2тв+3WO42-раств (10.18)
Произведения растворимости СаWO4 равно:
LCaWО4 = aCa2+ a WO42-, (10.19)
LCa3(PO4)2 = a3Ca2+ a2 PO43-. (10.20)
Отсюда:
KP = a3 WO42- / a2 PO43- = L3 CaWo4 / L Ca3(PO4)2. (10.21)
Расчет констант равновесия по данным о значениях электрохимических потенциалов. Если в процессе выщелачивания протекает окислительно-восстановительная реакция, ее константу равновесия можно определить по значениям электрохимических потенциалов.
Реакцию между восстановленной формой А и окисленной формой В:
Авосст + Вокисл 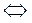 Аокисл + Ввосст (10.22)
Аокисл + Ввосст (10.22)
можно осуществить таким образом, чтобы процессы окисления и восстановления протекали раздельно на электродах, образующих гальванический элемент:
1) Авосст 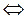 Aокисл + n e, (10.23)
Aокисл + n e, (10.23)
2) Вокисл + n e 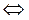 Ввосст. (10.24)
Ввосст. (10.24)
Потенциал каждого из электродов относительно стандартного водородного определяется выражением:
j = jo +[RT /(nF)]ln(аокисл/авосст), (10.25)
где: jo – стандартный потенциал электрода;
n – число электронов, принимающих участие в процессе;
F – число Фарадея, F = 96493 Дж/В·г-экв,
где: В – степень окисления.
Электродвижущая сила элемента (Е) вычисляется как разность потенциалов электрода, на котором протекает восстановительная реакция (10.2), и электрода, на котором протекает окисление (1):
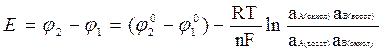 (10.27)
(10.27)
После того, как установится равновесие, переход электронов должен прекратиться. Очевидно, условием этого является равенство потенциалов электродов. Приравняв разность j1 и j2 нулю, и выполнив преобразования уравнения (10.27), получаем:
jо2 - jо1 = 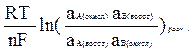 . (10.28)
. (10.28)
Поскольку входящее в уравнение (14) соотношение равновесных активностей равно Кр, а разность стандартных потенциалов - стандартной электродвижущей силе элемента Ео, получаем уравнение:
RT ln KP = n F Eo . (10.29)
Сравнивая уравнения (10.14) и (10.29), видим:
Go = - n F Eo. (10.30)
При пользовании таблицами электродных потенциалов, приведенными в различных справочниках, необходимо учитывать систему знаков, принятую при составлении последних. В соответствии с действующими в настоящее время правилами электроду приписываются те же знаки и величина потенциала, которые он имеет по отношению к стандартному водородному электроду. При соединении данного электрода не с водородным, а с каким-либо другим электродом, направление протекающего в нем процесса может измениться на противоположное, однако знак потенциала сохраняется. Так, например, стандартный потенциал электрода Zn2+/Zn равен – 0,76 В независимо от того, протекает в нем реакция:
Zn ®Zn2+ + 2 e (10.31)
или
Zn2+ + 2 e ® Zn. (10.32)
Такая система знаков принята в большинстве изданий по этому вопросу.
Если уравнение электродной реакции совпадает с направлением ее самопроизвольного протекания, потенциалу электрода приписывается знак «плюс», в противоположном случае – «минус». Например, по американской системе электрод:
Zn ® Zn2+ + 2 e, (10.33)
имеет потенциал + 0,76 В, так как реакция перехода цинка в ионы в присутствии кислоты может протекать самопроизвольно, а потенциал электрода:
Zn2+ + 2 e ® Zn, (10.34)
принимается равным – 0,76 В.
 2015-05-12
2015-05-12 2116
2116
