Потенциал ионизации
Ионизацию можно рассматривать как крайний случай возбуждения, когда электрону сообщается энергия большая, чем энергия самого высокого возбужденного уровня атома.
Чтобы вырвать электрон из атома (молекулы), нужно затратить энергию, равную энергии его связи в атоме. Эту энергию называют потенциалом ионизации Ui и часто выражают в вольтах (точнее, в электронвольтах). Первый потенциал ионизации – потенциал ионизации, соответствующий удалению наиболее слабо связанного электрона из нейтрального невозбужденного атома; удалению из ионизированного атома следующих электонов соответствуют второй, третий и т. д. потенциалы ионизации.
Таблица 3.1 – Значения первого потенциала ионизации Ui
| Атом | Cs | K | Na | Ca | Fe | H | O | N | Ar | F | Ne | He |
| Ui, эВ | 3,9 | 4,3 | 5,11 | 6,08 | 7,83 | 13,53 | 13,56 | 14,5 | 15,6 | 18,6 | 21,5 | 24,6 |
Неупругие соударения частиц между собой при высоких температуре и плотности газа приводят к так называемой термической ионизации, которая возникает за счет кинетической энергии частиц. Наиболее вероятна следующая схема неупругого соударения быстрого электрона и атома:
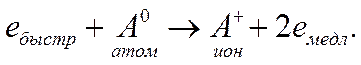 (3.35)
(3.35)
Результатом неупругого соударения будет образование иона и двух электронов, обладающих малыми скоростями. Затем электроны снова начнут ускоряться электрическим полем.
Ионизация холодной плазмы осуществляется осуществляется весьма небольшим числом высокоскоростных электронов, соответствующих «хвосту» максвелловского распределения. Поэтому неупругих столкновений в сварочном столбе дуги обычно значительно меньше, чем упругих.
Энергия ионизации, численно равная Ui, зависит от строения атома, т. е. от его места в периодической системе элементов (рисунок 2.11). Потенциал ионизации Ui представляет собой периодическую функцию атомного номера элемента Z, и значения Ui снижаются с уменьшением номера группы и увеличением номера периода таблицы. Наименьший потенциал ионизации (Ui = 3,9 эВ) имеют пары цезия Cs.
Рисунок 2.11 – Потенциалы ионизации химических элементов в зависимости от их порядкового номера Z в периодической системе элементов
Единственный валентный электрон у щелочных металлов первой группы слабо связан с ядром, поэтому и энергия ионизации щелочных металлов невелика. Наивысший потенциал Ui = 24,6 эВ наблюдается у самого легкого из инертных газов – гелия Не. Оболочка инертных газов заполнена и поэтому наиболее прочна.
 2014-02-09
2014-02-09 1564
1564
